歡迎關注凱萊英藥聞
由於腫瘤細胞可藉助免疫檢查點受體躲避免疫系統的識別和殺傷, 使得阻斷免疫檢查點受體成為近年來腫瘤免疫治療的新思路。目前開發較為成熟的受體靶點包括程式性死亡蛋白1及其配體(PD-1/PD-L1)和細胞毒性T淋巴細胞相關抗原-4(CTLA-4), 但由於在其相關抗體治療過程中患者出現耐受, 新靶點的尋找與開發成為新的研究熱點。LAG-3全稱為淋巴細胞活化基因3(Lymphocyte Activation Gene-3),又稱CD223,主要功能是負調控T細胞的功能,屬於免疫球蛋白超家族成員。LAG-3分子最早於1990年被發現,首次分離出LAG-3分子的cDNA克隆, 同年發現該分子的免疫調控機制, 並於1992年證實主要組織相容性複合體II類分子(MHC II) 為LAG-3的主要配體。LAG-3分子可負向調節T細胞, 在維持機體免疫系統穩態和促進腫瘤免疫逃逸方面扮演重要角色。作為新靶點之一,LAG-3在腫瘤免疫治療方面存在巨大潛力[1]。
圖片來源:MDPI
LAG-3在多種實體瘤的腫瘤浸潤淋巴細胞(TIL)中存在高表達,這些耗竭的CD4+和CD8+TIL表達的細胞因子明顯減少。一項對肝癌患者的研究表明人肝癌組織特異性T細胞上LAG-3的表達明顯高於無腫瘤肝組織和外周血[2]。LAG-3的阻斷可以增強TIL的增殖以及細胞因子的分泌,增強抗腫瘤免疫。阻斷LAG-3的臨床前癌症治療模型表明,腫瘤部位的抗原特異性T細胞活化增強,腫瘤生長受到抑制,並且破壞了腫瘤實質部分[3]。LAG-3在人膠質母細胞瘤樣品的TIL和與腫瘤相關的血管周圍淋巴細胞上表達,單獨使用LAG-3或與抗PD-1組合使用,在根除膠質母細胞瘤小鼠方面非常有效[4]。對黑色素瘤,結直腸癌和非小細胞肺癌患者研究發現外周血和腫瘤組織中的Treg細胞上都表達了LAG-3,這種表達LAG-3的Treg細胞產生高水平的免疫調節細胞因子IL-10和TGF-β,並抑制TIL的活化[5]。LAG-3參與了類似PD-1的腫瘤免疫逃逸機制,目前針對LAG-3的免疫治療開發出的主要抑制方法:LAG-3-Ig融合蛋白和靶向LAG-3的單抗/雙抗。
一、LAG-3藥物的最新進展
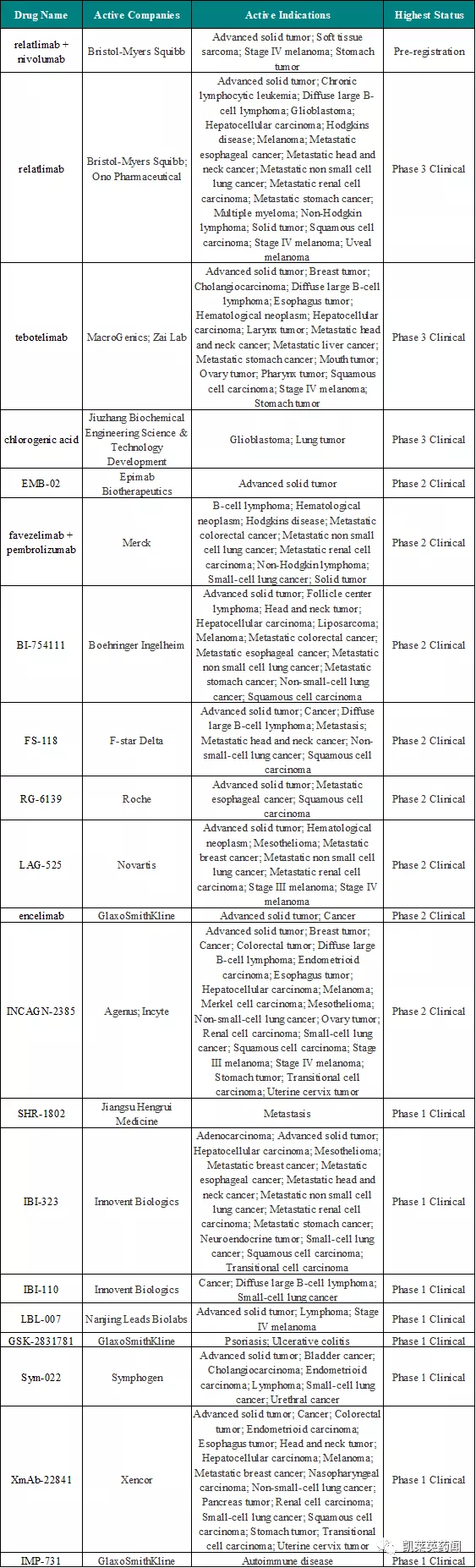
1、據不完全統計,從研究階段看,目前LAG-3相關藥物53個,尚未有藥物獲批,其中預註冊1個,III期臨床3個,II期臨床8個,I期臨床8個,臨床前24個,開發階段9個。
2、從適應症上看,以治療實體瘤特別是晚期實體瘤的藥物為主,包括鱗狀細胞癌(8)、肝細胞癌(6)、小細胞肺癌(6)和非小細胞肺癌(4)、IV期黑色素瘤 (6)、瀰漫性大 B 細胞淋巴瘤(5)、轉移性胃癌(5)、轉移性乳腺癌(4)、轉移性食管癌(4)、轉移性頭頸癌(4)、轉移性腎細胞癌(4)等。
3、從研究企業看,國內外齊頭並進,其中Immutep擁有藥物4個,GlaxoSmithKline(GSK)擁有藥物4個,Bristol-Myers Squibb(BMS)擁有藥物3個,Avacta擁有2個,Merck擁有2個,Roche擁有2個,Xencor擁有2個;國內企業信達(2)、再鼎(1)、岸邁生物(1)、恆瑞(1)、科倫(1)、哈爾濱譽衡(1)、天境生物(1)、復宏漢霖(1)也均在該領域進行佈局。
4、將目前處於臨床以上階段的藥物情況統計如下:
二、重點藥物介紹
LAG-3作為“免疫治療2.0”中的熱門靶點,研發一開始卻屢屢碰壁,直到2018年華人科學家陳列平找到了LAG-3的配體FGL1,為靶向LAG-3的免疫治療進一步打下了理論基礎[6]。LAG3的配體主要包括MHC II、半乳糖凝集素-3、肝竇內皮細胞凝集素(LSECtin)和FGL1。FGL1,也稱為肝纖維蛋白原相關基因-1(LFIRE-1),是肝臟分泌的一種增殖和代謝相關因子。它作為一種新的LAG-3配體出現,能與LAG-3結合形成獨立於PD-1/PD-L1的新免疫檢查點通路,導致T細胞耗竭和隨後的功能障礙,以及腫瘤細胞逃避免疫監視。除了在肝臟和胰腺中相對較高的表達外,FGL1在腫瘤組織(包括肺、前列腺、黑色素瘤、結直腸、乳腺和腦腫瘤)中表達上調。紀念斯隆凱特琳癌症中心(MSKCC)的科學家也發現,外周血中LAG-3陽性的CD8+T細胞的黑色素瘤患者和尿路上皮癌患者,接受PD-1治療的效果較差。因此,LAG-3和PD-1的雙重阻斷可以強烈增強新免疫反應的啟動。
01 國外BMS和默沙東領銜,製藥巨頭紛紛入局
BMS公司研發的relatlimab是目前研發進度最快的LAG-3抗體,已經啟動全球範圍的II/III期臨床試驗。在今年的ASCO大會上,BMS公佈了其LAG-3抗體relatlimab與PD-1抗體納武單抗聯合用於治療晚期黑色素瘤的試驗結果,顯示將714名晚期黑色素瘤患者被隨機分配接受relatlimab+納武單抗聯合治療或納武單抗單藥治療,其中355名接受relatlimab+納武單抗治療的患者,中位無進展生存期10.1個月,1年無進展生存率47.7%;359名接受納武單抗單藥治療的患者,中位無進展生存期4.6個月,1年無進展生存率36.0%;relatlimab的加入讓晚期黑色素瘤患者疾病進展的風險降低了25%。BMS公司也據此向FDA提交了上市申請,預測將成為該領域首個獲批藥物。
圖片來源:BMS官網
在PD-1抗體領域,K藥(默沙東生產)和O藥(BMS生產)就是星光熠熠的雙雄。LAG-3抗體,同樣也是這兩家你追我趕。MK-4280A是一種由LAG-3抗體favezelimab(MK-4280)和PD-1抑制劑Keytruda的聯合治療方案,其中favezelimab能夠阻斷MHC II類受體與LAG-3之間的相互作用,抑制LAG-3上調,進而恢復T細胞對腫瘤細胞的殺傷效應。2021年ASCO年會期間,默沙東首次公佈了favezelimab聯合Keytruda治療微衛星穩定性(MSS)結直腸癌(CRC)患者的I期臨床試驗資料。研究結果顯示,在客觀緩解率(ORR)方面,PD-L1綜合陽性評分(CPS)≥1組(n=36)為11%,PD-L1 CPS <1組(n=35)為2.9%;在疾病控制率(DCR)方面,PD-L1 CPS ≥1組為36.1%,PD-L1 CPS <1組為14.3%;兩組的中位緩解持續時間(DOR)均為10.6個月。
圖片來源:2021 ASCO
除BMS和默沙東外,各大製藥巨頭包括GlaxoSmithKline 、Boehringer Ingelheim、諾華等紛紛入局。其中BI-754111則是由Boehringer Ingelheim開發的一種LAG-3的單克隆抗體,在劑量遞增階段的I期臨床研究中,聯合BI-754091(抗PD-1)治療難治性實體瘤,主要終點分別為劑量限制性毒性(DLT)、最大耐受劑量(MTD)和ORR。後期的生物標誌物分析顯示,對治療產生部分響應(PR)或穩定疾病(SD)的患者IFN-γ基因特徵分數增高。此外,在治療前活檢標本中,PD-L1基因表達高的患者的治療效果較好[7]。
圖片來源:InOncology
02
國內企業百花齊放,佈局雙抗成為主流
除國外企業的激烈競爭外,國內企業針對LAG-3藥物的研發也是百花齊放。Tebotelimab (MGD013)是一款同類首創PD-1/LAG-3 DART分子雙特異性抗體,再鼎醫藥於2018年11月從MacroGenics公司獲得其在中國大陸、香港、澳門和臺灣地區的開發與推廣權。目前,MacroGenics正在開展依布妥組單抗聯合retifanlimab或tebotelimab用於頭頸部鱗狀細胞癌(SCCHN)一線治療的Ⅱ期臨床研究;2021年6月和7月,再鼎醫藥完成了膽管癌和三陰性乳腺癌的兩組佇列的首批患者入組;此外,在胃癌免疫治療領域,正在使用tebotelimab與PARP抑制劑尼拉帕利聯合探索在胃癌中的應用。
圖片來源:MacroGenics
EMB-02是由岸邁生物自主開發的一款同時靶向免疫檢查點蛋白PD-1和LAG-3的雙特異性抗體,旨在同時或獨立靶向人類 PD-1和 LAG-3,並破壞這兩種途徑介導的免疫抑制,從而恢復T細胞效應功能並增強抗癌活性。目前,在中國的IND申報已獲CDE批准。正在進行的一項全球 I/II 期研究顯示:EMB-02已表現出顯著的抗腫瘤活性;在給藥治療後,EMB-02給藥組有一半的腫瘤出現完全消退。
圖片來源:岸邁官網
此外,信達生物也在研發同時靶向LAG-3和PD-L1的雙特異性抗體IBI-323,於2020年10月獲得臨床試驗默示許可,擬開發用於治療晚期惡性腫瘤。在臨床前研究中,IBI-323已顯示出體外療效及體內療效,比抗PD-L1單抗和抗 LAG-3單抗的組合更有效和持久地啟用T淋巴細胞啟用。2021年7月,一項開放標籤、多中心的I期劑量遞增和擴充套件研究在中國開展,旨在評估 IBI323 在標準護理治療中癌症進展的晚期惡性腫瘤患者中的安全性、耐受性、潛在最佳劑量和初步療效。
展望
LAG-3已被證明在多種型別的細胞中表達,但其配體及其訊號傳導機制、與腫瘤的免疫逃逸之間的關係、與PD-1協同作用的分子機制、以及與其他免疫檢查點的補償作用機制等問題仍需更進一步的研究來解決,以評估LAG-3相關藥物的長期安全性和有效性。期待LAG-3相關藥物獲批,為癌症患者帶來更多的福音。
參考文獻
[1] 田寶俊, 於紅陽, 徐明波,等. LAG-3的免疫學功能及其抗體藥物的研究進展[J]. 中國細胞生物學學報, 43(2):9.
[2] Zhou G , Sprengers D ,Boor P P C , et al. Antibodies Against Immune Checkpoint MoleculesRestoreFunctions of Tumor-Infiltrating T Cells in HepatocellularCarcinomas[J].Gastroenterology, 2017:1107.
[3] LAG-3 regulatesCD8+ T cell accumulation and effector function in murine selfandtumor-tolerance systems.[J]. Journal of Clinical Investigation, 2007.
[4] Harris-Bookman S ,Mathios D , Martin A M , et al. Expression of LAG‐3 and efficacy of combinationtreatment with anti‐LAG‐3 and anti‐PD‐1 monoclonal antibodies inglioblastoma[J]. International Journal of Cancer, 2018, 143.
[5] Camisaschi C , Casati C, Rini F , et al. LAG-3 expression defines a subset of CD4(+)CD25(high)Foxp3(+)regulatory T cells that are expanded at tumor sites.[J]. Journal of Immunology,2010, 184(11):6545.
[6] Wang J , Sanmamed M F , Datar I , et al.Fibrinogen-like Protein 1 Is a Major Immune Inhibitory Ligand of LAG-3[J].Cell, 2018, 176(1-2).
[7] Johnson M L , Patel M R , Cherry M , et al. Safety ofBI 754111, an anti-LAG-3 monoclonal antibody (mAb), in combination with BI754091, an anti-PD-1 mAb, in patients with advanced solid tumors[J]. Journal ofClinical Oncology, 2020, 38(15_suppl):3063-3063.