腦轉移發生在約 10%~15%的晚期腎細胞癌 (RCC)患者中,與高死亡率相關。這類患者亟需有效的治療藥物。卡博替尼在晚期RCC患者中顯示出較好的抗腫瘤活性,但對於腦轉移RCC患者的療效未知,本研究旨在評估卡博替尼治療腦轉移RCC患者的抗腫瘤活性和安全性。近日,該研究結果發表在《JAMA Oncology》雜誌。
研究背景
腦轉移治療的金標準是區域性治療,包括立體定向放射外科治療、全腦放療和外科手術治療。腦轉移RCC患者的體力狀態較差,且通常需馬上進行區域性治療,因此,靶向治療的大部分臨床試驗通常將這類患者排除在外。
目前對於腦轉移RCC患者,大多數靶向藥物的抗腫瘤療效資料來自回顧性研究、前瞻性單臂臨床研究。
卡博替尼是一種多靶點小分子TKI,可靶向多個靶點,包括VEGFR2、MET、AXL、RET和KIT,通常這些訊號通路介導腫瘤細胞存活、轉移和腫瘤血管生成。
基於一項II期前瞻性研究,卡博替尼單藥已成為晚期RCC患者的治療方案之一。但前瞻性臨床研究均不允許納入進展性腦轉移患者。在3個單例病例報告和12例患者的小型回顧性研究中,卡博替尼顯示出初步結果,研究提示卡博替尼有穿過血腦屏障並治療腦轉移的潛力。
研究方法
這是一項國際化、多中心回顧性佇列研究,納入2014年1月至2020年10期間15個國際醫療中心的腦轉移RCC患者。研究分為兩個佇列,佇列 A 納入卡博替尼治療開始時進展性腦轉移患者,並且過去2個月內無腦定向區域性治療。佇列 B 納入卡博替尼治療開始時穩定性腦轉移患者,或同時接受腦定向區域性治療的進展性腦轉移患者。研究評估了顱內和顱外客觀緩解率(ORR)、至治療失敗時間(TTF)和總生存期(OS)和安全性。
研究結果
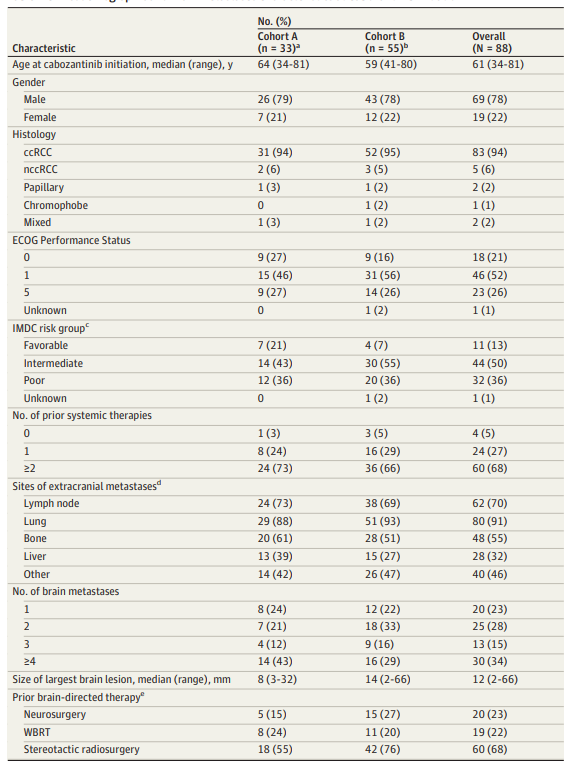
研究共納入4個國家15個國際中心接受卡博替尼治療的88例腦轉移晚期RCC患者。其中,A佇列有33例(38%)患者在開始卡博替尼治療時有顱內進展並且無伴隨腦定向區域性治療。B佇列納入55例(62%)患者。佇列A中,既往腦定向區域性治療至卡博替尼開始治療的中位時間為5個月。佇列B中,64%(35/55)患者有影像學確認的顱內進展並伴隨腦定向區域性治療,36%(20/55)患者在開始卡博替尼治療時為穩定性腦轉移。
總體上,大部分患者為男性(78%),且體力狀況較好(見表1)。
表1 卡博替尼開始治療時的患者特徵
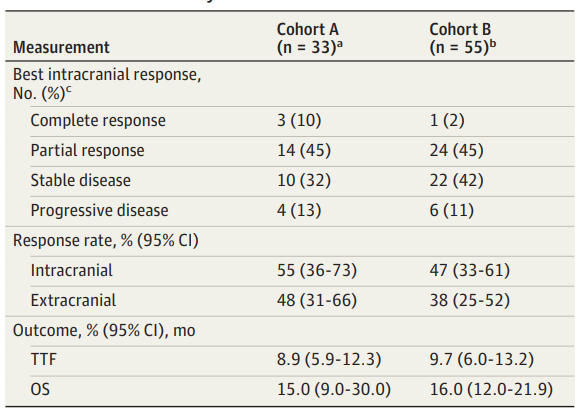
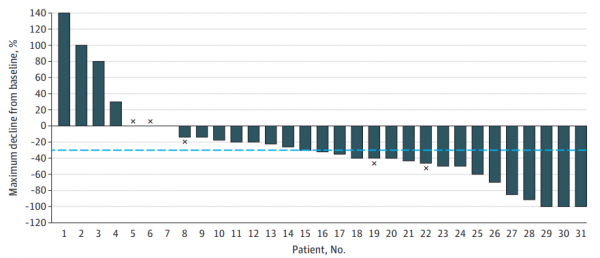
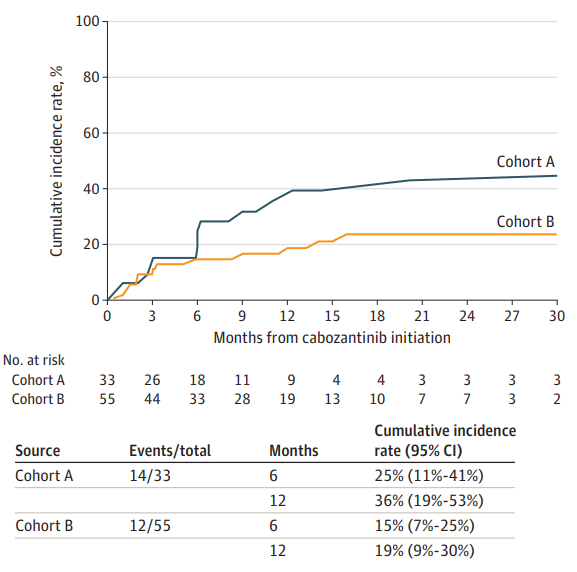
佇列A的顱內ORR為55%,其中3例患者完全緩解(CR),14例患者部分緩解(PR)(表2)。10例患者的最佳緩解為疾病穩定,4例患者未顯示臨床反應,且發生初步進展。2例患者由於病灶<5mm而無法評估顱內治療反應。3例顱內CR患者均為腎透明細胞癌: 2例患者出現獨立腦病灶(分別為16mm和7mm), 1例患者出現2個腦病灶。圖1為A佇列自基線起顱內腫瘤縮小最佳百分比。A佇列6個月顱內進展率為25%(圖2)。
表2 卡博替尼的抗腫瘤活性
佇列B的顱內ORR為47%,其中,1例患者達到CR,24例患者達到PR。6例患者的最佳緩解為進展性顱內疾病,既往均接受了腦定向區域性治療。2例患者無法評估。接受伴隨放療患者的 ORR 為 54%(19/35)。佇列 B 的 6 個月顱內進展率為 15%(圖2)。
軟腦膜疾病患者亞組(n = 9)中,卡博替尼顱內(實質和軟腦膜疾病)和顱外反應率分別為56% 和44%,中位OS為 12 個月。
顱外活性和OS結果
佇列A的顱外ORR為48%,16例患者達到PR,在17例顱內緩解的患者中,11例患者達到顱外緩解,6例為顱外穩定性疾病。中位TTF為8.9個月(圖3),中位OS為15個月。佇列B的顱外ORR為38%,其中1例達到CR,24例達到PR。在25例顱內緩解的患者中,14例患者達到顱外緩解,8例達到顱外穩定性疾病。中位TTF為9.7個月(圖3),中位OS為16個月。
安全性
超過 30% 的患者發生最常見的治療相關不良事件,包括疲勞(n = 68 [77%])、腹瀉 (n = 40 [46%])、掌蹠感覺喪失性紅斑綜合徵(n = 28 [32%])和噁心(n = 27[31%])。15例患者發生3級或4 級治療相關不良事件,最常見的是疲勞(n = 6 [7%])和粘膜炎(n = 4 [5%])。
討論和結論
卡博替尼的抗腦轉移活性可能與抑制c-MET訊號通路相關。
卡博替尼在經其他治療且進展性顱內疾病患者無伴隨腦定向區域性治療患者中顯示出較高顱內ORR(55%)。
兩佇列結果顯示,卡博替尼顯示出與既往研究一致的安全性。治療期間,也未觀察到藥物相關神經系統不良事件。
參考文獻
Clinical Activity and Safety of Cabozantinib for Brain Metastases in Patients With Renal Cell Carcinoma. JAMA Oncol. doi:10.1001/jamaoncol.2021.4544.Published online October 21, 2021.