宮頸錐切術是切除部分子宮頸的一種手術,即由外向內呈圓錐的形狀切下一部分宮頸組織,包括宮頸環形電切術和冷刀錐切術。它一方面可用作病理檢查,以確診宮頸的病變程度,另一方面也是切除病變的一種治療方法。
01
何時切?
宮頸錐切術的指徵為宮頸鱗狀上皮內高度瘤樣病變(HSIL)或CIN2-3級。
禁忌症包括:
1.可疑浸潤癌或腺上皮不典型增生;
2.病變累及宮頸管範圍超過1cm,或看不見病變邊緣或上限;
3.宮頸感染或盆腔炎性疾病;
4.妊娠或產後12周內;
5.異常出血。
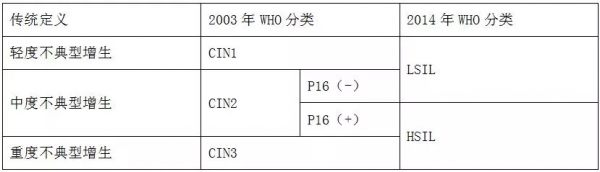
HSIL和LSIL是2014年WHO的新分類,免疫組化P16是HSIL和LSIL劃分的重要標誌,具體劃分如下表:
02
如何切?
(一)宮頸錐切術分型
在傳統的手術學圖譜中,宮頸錐切術的切除範圍包括整個鱗柱交界,錐高在2.5cm以上,所以過去手術範圍較大。目前,宮頸錐切術分為三型,要求切除完整的轉化區和鱗柱交界部以上的部分宮頸管。
因此,可根據宮頸移行區的位置來決定宮頸錐切的發小,且切除範圍一定要包括宮頸移行區。
(二)宮頸錐切術分類
根據手術器械型別,宮頸錐切術包括宮頸冷刀錐切(CKC)、宮頸電刀錐切(EKC)、宮頸環形電切(LEEP)、宮頸射頻刀錐切、宮頸冷凍治療等。但射頻治療和冷凍治療破壞宮頸組織,無法進行病理檢查。
1.宮頸冷刀錐切是宮頸錐切術的標準術式。其主要優勢為:
(1)可一次性切除足夠大的、完整的宮頸用於組織病理檢查,且錐切標本邊緣的切淨率較高;
(2)切除標本邊緣不影響組織病理學診斷;
(3)可用於腺上皮異常者的診斷。但該手術方式出血不易控制,易引起併發症。
該手術方式主要適用於以下情況 :
(1)宮頸細胞學HSIL,陰道鏡檢查陰性或不滿意;
(2)陰道鏡檢未看到病變的邊界或未見鱗柱交界的上界;
(3)主要病灶位於宮頸管內或HSIL延伸入宮頸管內;
(4)TCT診斷較陰道鏡下宮頸活檢的病理結果重(相差2級);
(5)宮頸管搔刮術(ECC)的病理結果為異常或不能確定;
(6)TCT示腺上皮異常或可疑宮頸腺癌或原位癌;
(7)宮頸活檢病理提示可疑微小浸潤癌;
(8)TCT、陰道鏡懷疑宮頸浸潤癌,但活檢病理未能證實;
(9)外宮頸病變範圍廣,累及宮頸四象限,甚至延伸至陰道穹窿。
需要注意的是以上宮頸冷刀錐切術的適應症均不適宜行LEEP治療。
2.宮頸電刀錐切就是應用電刀取代冷刀,該手術可獲取足夠大的宮頸椎體用於病理檢查,且術中出血少,止血效果好,但電刀可致切緣電凝處組織變性,影響病理醫生對靠近切緣處病變的判斷。該缺點隨著P16染色的出現被彌補,如果P16染色瀰漫強陽性,代表切緣陽性,即切緣未切淨;如果P16染色陰性,說明是電凝導致了組織變性。
3.宮頸電熱圈環切術(LEEP)是透過環形金屬絲(圈電極)傳到高頻交流電,利用高頻電流所特有的乾燥脫水效應、電弧切割效應來對電極接觸的組織進行快速切開。常用的切除模式為移行帶環切術和子宮頸環錐切。LEEP用於CIN1和ASC-US診斷時,活檢的宮頸深度和頸管的深度約4mm,既可達到診斷和治療作用,又避免切除過多組織,比宮頸鉗活檢術優越。
4.銳扶刀的形狀與LEEP有相似之處,銳扶刀宮頸錐切是一種射頻消融技術,最大的優點是止血效果好,切緣沒有熱損傷,不影響病理診斷。
(三)術後處理
宮頸錐切術後處理是臨床醫生需要重點關注的內容之一,包括術後併發症的處理、術後隨訪和術後妊娠的相關問題。
1.宮頸錐切術後併發症
宮頸錐切術後併發症包括出血、感染、宮頸管口粘連、創面子宮內膜異位症等。出血是最常見的術後併發症,有術後早期和晚期出血。術後早期出血是指宮頸錐切術後即刻出血和術後1-2天內創面出血,多因手術止血不徹底導致,可根據術者經驗術中採用“8”字或鎖邊縫合創面防治出血。然而,術者在止血時一方面要考慮如何妥善止血,另一方面還要考慮如何防止術後宮頸管粘連,可採用宮頸管處放置導尿管、碘伏紗條等措施。此外,強調月經乾淨以後行宮頸錐切手術,其主要原因包括兩方面:①區別陰道出血是月經血還是手術創面出血;②降低宮頸創面子宮內膜異位症發生風險。
2.宮頸錐切術後隨訪
由於宮頸錐切術後患者比普通人群患宮頸癌風險高2-5倍以上,因此術後要定期隨訪。術後1-2個月隨訪主要觀察創面癒合程序,術後6個月行TCT及HPV檢測,隨訪陽性者則需要陰道鏡再次評估。
03
切緣陽性怎麼辦?
1.切緣未淨的定義
鱗狀上皮內病變:緊鄰切緣指病變距離切緣<1mm,切緣陰性指微小浸潤灶的病變距離切緣>3mm。
腺上皮病變:因其具有病變的跳躍性,要求病變距離切緣>7mm才安全。
宮頸管內切緣陽性:出現殘留復發的風險高。
2.切緣陽性的處理原則
符合以下條件者,可進行隨訪:
①無腺上皮異常證據;
②無宮頸管切緣陽性;
③無浸潤性病變的證據;
④患者年齡小於50歲。
當出現內切緣陽性,腺體受累或多象限受累,患者年齡≥50歲,陰道鏡檢查困難,隨訪條件差等情況時,需要行再次宮頸錐切術或子宮切除術。其中,單純全子宮切除的指徵主要包括:無生育要求;充分的宮頸切除後切緣仍為陽性;錐切治療後存在高級別細胞學異常;患者不願意接受保守治療;因某些原因無法進行充分的TCT,如宮頸管狹窄;患者存在其他切除子宮的指徵;已排除浸潤性疾病。
3.宮頸錐切術後復發
關於宮頸錐切術後復發的問題有個概念需要理解,即病變殘留和病變復發。病變殘留指術後6個月內發現宮頸病變,病變復發指術後6個月以上發現宮頸病變(第一次TCT複查陰性後又出現CIN者)。
宮頸錐切術後復發與手術方式、手術切緣狀況、腺體受累、HPV持續感染等因素相關。①研究顯示,CKC與LEEP相比,術後1年宮頸病變複發率低,HPV清除率高。②宮頸錐切術後切緣陽性複發率高,宮頸管搔刮術(ECC)可預測病灶殘留,對判斷宮頸管內病變和復發有很重要的意義。③研究發現,腺體受累者複發率是無受累的4.51倍,此時宮頸錐切的深度可影響病灶殘留和複發率。④錐切術後HPV逐漸被清除,多數在6個月內轉陰(術後6個月複查較為合理),但仍有20%的術後患者HPV持續感染。根據相關資料,LEEP術後3個月、6個月、9個月和12個月的HPV持續陽性率分別為44.6%、10.6%、2.1%和2.1%。資料調查發現HPV陽性者複發率明顯高於陰性者(9.2%:1.9%)。
04
宮頸錐切術與妊娠
1.宮頸錐切術對妊娠的影響
宮頸錐切術後由於宮頸長度縮短、宮頸壁變薄,約20%術後妊娠患者存在不良結局,晚期流產的比例是非錐切者的7倍,而錐切型別、錐切大小、宮頸長度是宮頸錐切術後早產的三個高危因素。
一組關於宮頸切除深度對妊娠結局的影響資料資料如下:
- 宮頸切除深度>10mm時,將增加早產的風險;
- 宮頸切除深度>12mm時,早產風險增加3倍;
- 宮頸切除深度10-14mm時,早產絕對風險為8%;
- 宮頸切除深度>20mm時,早產風險將上升至18%。
由上可知,宮頸錐切的錐高越高,早產風險將越大。
2.宮頸機能不全
(1)定義:早孕期無宮縮時出現宮頸擴張,而無法維持繼續妊娠
(2)診斷:
①病史:多次孕中期妊娠自然流產史或早產史;
②查體:8號宮頸擴張棒無阻力透過;孕期無痛性宮頸擴張,羊膜囊突出;
③子宮輸卵管造影:子宮峽部漏斗區呈管狀擴張;
④超聲:非孕期宮頸管寬徑>6mm,宮頸管長度<25mm,妊娠期宮頸內口呈漏斗狀擴張,孕24周內宮頸管長度≤25mm。
但由於所有的指南均反對進行診斷測試來評估宮頸機能不全,即以上客觀指標可供臨床參考,不能因為這些客觀指標擴大宮頸環扎術的手術指徵。
(3)宮頸環扎術:
①適應症:有3次或以上孕中期流產或早產史的患者;
②禁忌症:宮頸環扎術沒有絕對禁忌症,但在下生殖道炎症、陰道出血、胎兒異常、不可抑制早產等情況時禁行宮頸環扎術;
③手術時機:孕12-14周(最佳時機)進行預防性宮頸環扎術;孕24周內,超聲測量宮頸長度≤25mm,有自然流產或早產史的單胎妊娠患者;孕前宮頸環扎;
④手術方式:經陰道宮頸環扎,經腹(開腹或腹腔鏡)宮頸環扎;
⑤環紮帶拆除時機:產前36-38周或剖宮產時,出現胎膜早破等情況時。
05
妊娠期發現宮頸病變怎麼辦?
妊娠期間雌激素分泌增多,宮頸組織細胞出現類似原位癌的形態變化,因此,病理送檢時一定要註明“妊娠期間”字樣。因妊娠期間孕婦抵抗力下降,所以易發生HPV感染。目前沒有證據表明妊娠期間CIN比非孕期更易發展為宮頸浸潤癌,絕大多數宮頸病變可於產後自行緩解,因此一般妊娠期CIN的患者可以保守處理。
妊娠期間宮頸異常的處理原則如下:
- TCT異常應行陰道鏡檢查評估;
- 陰道鏡可疑浸潤癌應行宮頸活檢確診;
- TCT異常或活檢證實CIN者可以每10-12周複查一次,觀察病情變化;
- 產後6-8周進行再次評估以明確有無癌前病變,並做相應處理;
- 妊娠期發現宮頸癌前病變無需太過緊張。
綜上所述,宮頸錐切術的指徵為HSIL,LSIL和持續HPV感染均不是宮頸錐切的手術指徵。根據宮頸移行區的型別,宮頸錐切術分為三型。宮頸錐切術後切緣陽性是否即刻補做第二次錐切?需要具體情況具體分析,個體化選擇治療方案,不可激進處理。妊娠期發現宮頸病變時,可先保守處理,儘量不在孕期行宮頸錐切術。