引言
病毒感染是全球最重要的健康問題之一,特別值得關注的是那些可迅速演變為大流行病的高度傳染性病毒,例如登革熱病毒(DENV),其感染後可能產生一系列臨床疾病:急性登革熱(DF)、致命出血熱(DHF)或登革熱休克綜合徵(DSS)。目前,由於不清楚DENV感染的發病機制,尚未開發出針對DENV感染的特定治療方法。此外,開發針對所有DENV血清型的有效疫苗還在探索階段,目前批准的疫苗(CYT-TVDV,賽諾菲巴斯德)對2-17歲兒童的四種DENV血清型的療效仍低於60%。因此,早期發現病毒感染並進行積極的臨床干預仍然是控制感染和預防慢性病狀或死亡的最佳方法之一,開發用於快速診斷致病生物標誌物的檢測方法具有重要意義。
成果簡介
近期,佛羅里達大學光學與光子學院Debashis Chanda教授在《Nano Letters》上發表了題為“DNA-Modified Plasmonic Sensor for the Direct Detection of Virus Biomarkers from the Blood”的研究論文。作者開發了一種利用與微流體血漿分離器整合的腔耦合等離子體生物感測器直接從血液中檢測DENV生物標誌物的新方法。
圖文解讀
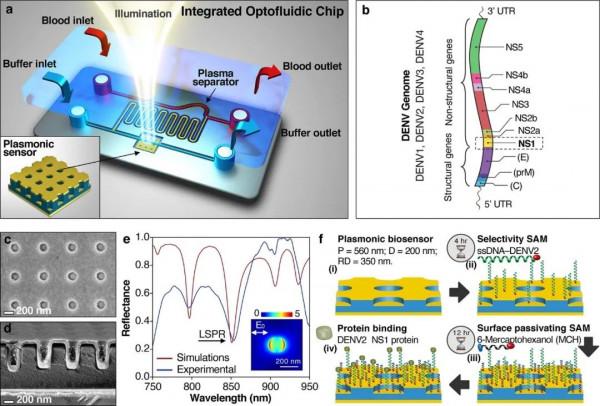
圖1: a)包含線上微流體血漿分離器和腔耦合奈米印跡等離子體陣列的整合登革熱病毒生物感測器示意圖。該感測器由金反射鏡(80 nm)、壓印有方形孔陣列的介電膜間隔片(約700 nm)、作為流體屏障的氧化鋁層薄膜(20 nm)和金薄膜(30 nm)共同組成,腔耦合提高了LSP共振的質量因數Q(頻寬,Δλ),而基於大面積平行奈米壓印的共振模式確保確定性共振複製(λR); b)登革熱病毒基因組由三種結構蛋白(C、prM和E)和七種非結構蛋白(NS)組成; c, d)奈米印跡感測器的掃描電子顯微鏡影象,c)為俯檢視,d)為橫截面圖; e)使用FDTD模擬得到的反射光譜(Q因子=53)(紅色曲線)和浸入水溶液(n=1.333)實驗所得反射光譜(Q因子=37)(藍色曲線)獲得的反射光譜,插圖表示在LSPR圓孔上方5 nm處獲得的電場增強,在共振(LSPR ∼ 850 nm)時,孔/盤陣列支援等離子體共振對周圍介質的變化極其敏感,導致共振頻率發生可測量的偏移;f)生物感測器工作流程:(i)批次製備感測器,(ii)可特異性結合非結構蛋白DENV2-NS1的ssDNA適配體透過末端的巰基共價結合到金表面,(iii)巰基封端的6-巰基己醇(MCH)自組裝單分子層與空表面積共價結合,以阻止血漿中的其他含量較高的蛋白質非特異性結合並減少生物流體中存在的蛋白質汙染,(iv)透過結合特異性ssDNA適配體檢測DENV2-NS1蛋白,產生可讀的LSPR位移。
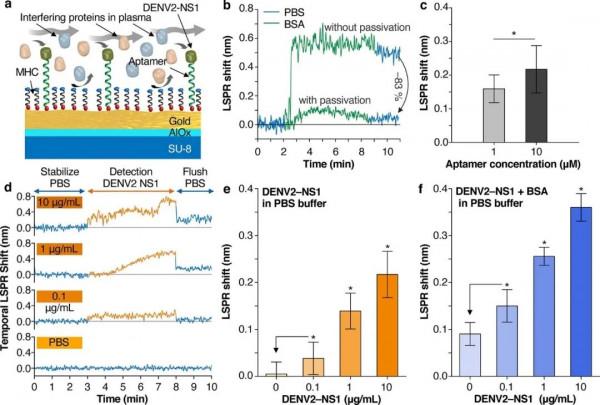
圖2: a)生物流體的生物感測方法:待檢測生物標誌物與ssDNA適配體特異性結合,並採用表面鈍化策略減少蛋白質汙染,使得在生物樣品中存在高蛋白質含量的情況下也能檢測目標抗原; b)與未鈍化的感測器相比,巰基封端的6-巰基己醇(MCH)表面鈍化的感測器減少了高達83%的感測器剩餘響應; c)測試同時功能化和表面鈍化的等離子體生物感測器,分別使用不同ssDNA適配體濃度(1、10 μM)進行功能化,LSPR偏移表明感測器結合生物標誌物的強度與ssDNA適配體的表面覆蓋程度相當,10 μM ssDNA適配體濃度下的LSPR偏移較大,此後均使用此濃度進行檢測; d)LSPR偏移的典型時間演變:使用整合的微流體系統,將感測器暴露於不同的DENV2-NS1蛋白質濃度(0.1、1、10 μg/mL)和對照溶液PBS中,感測器首先用PBS執行緩衝液穩定,然後PBS+DENV2-NS1溶液流動5 min,再用PBS沖洗,同時使用帶有定製LabVIEW(國家儀器)圖形的自動化光譜儀以每秒間隔連續收集反射光譜使用者介面; e)為d)中四種感測器的LSPR位移量化,對照溶液的LSPR偏移為0驗證了氧化鋁鈍化層的效果; f)在PBS+BSA buffer中,測試DENV2-NS1蛋白的LSPR變化,觀察到僅在PBS+BSA的對照溶液中具有較小的背景(0.090 ± 0.024 nm),對於最低的DENV2-NS1濃度,感測器響應為(0.150 ± 0.035 nm)
圖3: 在PBS中檢測DENV1和DENV2 NS1蛋白。測試四種PBS+BSA(100 μg/mL)溶液的LSPR響應:10 μg/mL的DENV1-NS1、10 μg/mL的DENV2-NS1、每種10 μg/mL的混合物和對照(PBS中的100 μg/mL BSA),DENV1和DENV2之間NS1蛋白的密切遺傳匹配(71.67%)導致有限的LSPR偏移。
圖4:a) 操作過程中血漿分離的顯微鏡照片:直接從血液中檢測需要四個步驟,1、PBS和血液同時以低速(~0.02 mL/min)流動,使溶液充滿通道,2、一旦LSPR訊號穩定,PBS通道關閉,同時血流量增加至~0.1 mL/min,直至血漿分離前2 min,3、一旦無細胞血漿在主動感測區域流動,血流停止,並孵育血漿樣本3 min,4、PBS通道開啟,將血漿和其他蛋白質從活性區域(λR)沖洗掉;b)血液生物感測過程中的兩個代表性感測器,首先透過流動的PBS建立基線,然後開始血漿分離,孵育3 min,最後用PBS沖洗,藍色區域是PBS流動事件,紅色區域對應於血漿分離和檢測,透過與生物標誌物的結合獲得LSPR偏移,觀察到LSPR中的尖峰主要是由於與殘餘血細胞、折射率梯度、LSPR跟蹤丟失或反射光譜變平有關但與生物標誌物結合無關的事件;c)檢測不同濃度(0.1、1、10 μg/mL)的DENV2-NS1蛋白(血液),DENV2-NS1蛋白在不同濃度下可以明顯區分。
總結展望
總而言之,作者開發了一種具有潛在便攜性的生物感測平臺,有利於應用在缺乏及時篩查的足夠基礎設施的偏遠地區。奈米壓印光刻提供並行、低成本和高吞吐量的奈米圖案化能力,可以與工業批處理相結合,有利於進一步的商業化。
文獻連結
https://pubs.acs.org/doi/full/10.1021/acs.nanolett.1c01609