RBD1016(SR016),是由我國蘇州瑞博生物技術有限公司自主研發的一款在研乙肝新藥,正在健康志願者中評價安全性和藥代動力學特徵( Ia期臨床研究),I期在慢性乙肝感染受試者中的 I期研究正在篩選患者階段。
在研乙肝新藥RBD1016,I期臨床研究,正進行單劑量爬坡中
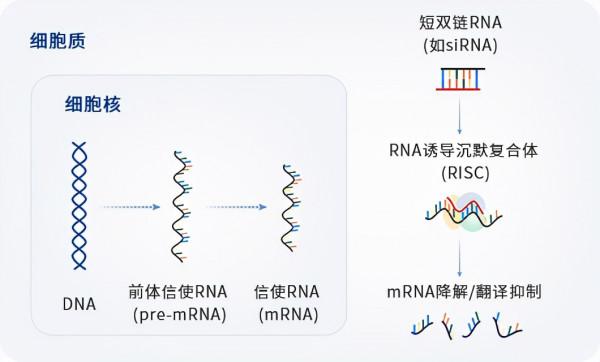
該候選藥物是瑞博生物自主研發的小干擾RNA(siRNA),和以往核苷(酸)類似物(NAs)或干擾素(IFN)對比,具有全新的作用機理。在其以往前期研究中,被證明不僅能夠抑制HBVDNA複製,並且能夠更高效地調降乙肝表面抗原(HBsAg)、乙肝e抗原(HBeAg)併產生表面抗原抗體,有望實現功能性治癒HBV。
一、Ia期健康志願者部分(正進行)
RBD1016在健康志願者部分正在進行中,這是一項隨機、雙盲、安慰劑對照、單劑量爬坡(遞增)的 Ia期臨床試驗,研究人員將觀察RBD1016在健康志願者中的安全性和藥代動力學特徵。研究分篩查期(第28天至第1天)、治療期(第1天至第2天)、安全性評估期(第29天)和安全性隨訪期(至第85天)。
Ia期研究納入40名健康志願者,包括5個劑量爬坡佇列,起始劑量為0.3 mg/kg。所有健康受試者將在第29天至第85天進行安全隨訪。Ia期研究已於2021年初開始,預計2021年底完成。該研究已於2021年1月獲得澳洲醫院的 EC 和 TGA批准,正進行單劑量爬坡階段。

來自:瑞博生物藥物開發管線,可見HBV-X SR016專案正在臨床I期
二、I期慢HBV患者部分(篩選中)
RBD1016在慢性乙肝病毒(HBV)感染患者中的單次和重複劑量遞增 I期研究,正在篩選患者階段。這是一項隨機、雙盲、安慰劑對照、單(A部分)和重複劑量(B部分)遞增的 I期臨床試驗,旨在評估RBD1016在慢性HBV感染患者中的安全性、藥代動力學(PK)和初步藥效學(PD)(臨床試驗編號:NCT05017116)。
安慰劑對照品是恩替卡韋(ETV),I期研究共有兩個部分組成,A部分是單劑量遞增研究,慢性HBV感染受試者將被分配,接受單劑量的RBD1016或安慰劑;B部分是多劑量遞增研究,慢性HBV感染受試者將被分配,接受兩劑的RBD1016或安慰劑。計劃納入54名慢性HBV感染受試者,2021年8月開始,計劃2024年完成。
RBD1016在慢性HBV患者部分,已於2021年5月獲得中國香港大學的 IRB批准,並於2021年6月獲得中國香港 DOH批准,目前,正在篩選患者階段。
小番健康結語:國內以RNAi技術開發在研乙肝新藥的藥企中,以往暫時只關注到舒泰神(北京)生物製藥開發的一款STSG-0002注射液正在進行 I期臨床研究。今年以來,新增一種相同作用機理RNAi,即瑞博生物研發的siRNA分子-在研乙肝新藥RBD1016注射液(皮下注射),在其非臨床研究顯示,可高效、強效降低血清和肝組織中的乙肝表面抗原水平,單次給藥後對乙肝表面抗原抑制作用可持續近6個月,並實現血清學轉換;
三、非臨床研究和作用機理
在與恩替卡韋進行組合使用後,對HBVDNA的抑制作用具有疊加效應。這也是一款新機制的在研乙肝新藥,且由我國藥企自主研發,健康志願者部分正在進行當中,在慢性HBV感染受試者部分正在篩選患者中。
從作用機理看,該候選藥物是瑞博生物自研的小核酸藥物,由siRNA和GalNAc遞送載體組成。活性成分可靶向HBV X基因保守區,透過RNA干擾對乙肝病毒的四個轉錄本均有抑制作用。