研究人員頭一回在一個分子內部以三維影象的形式直接捕獲原子的模糊輪廓!實現了上述創舉的冷凍電鏡還有望揭開更多生物程序的奧秘。
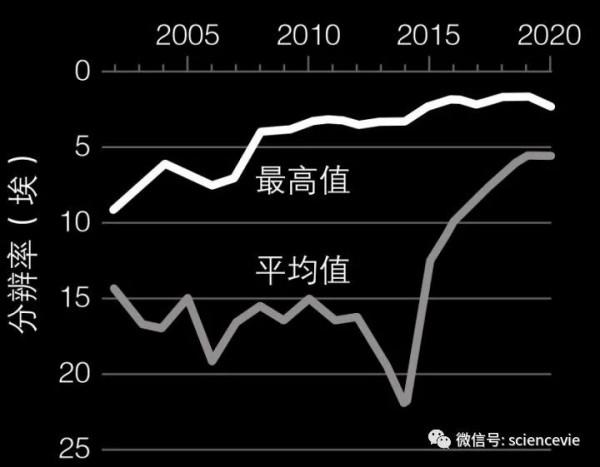
1.2 埃:這是該影象的解析度。也就是說,它能顯示的細節精度達 0.12 奈米,逼近最小的原子,即氫原子的直徑!圖中出現了去鐵鐵蛋白大分子中的碳、氧、氮等原子。在原子級解析度冷凍電鏡出現之前,這些細節只能透過 X 射線晶體學方法重建。
前頁這張照片得到了業內人士的一致讚賞。
我們可以看到,這是一個存在大量分支的球狀物,上面裝飾著去鐵鐵蛋白(血液中的鐵轉運蛋白)的大分子,甚至可以從中解析最小的原子——電子顯微鏡首次達到1.2埃(0.12奈米)的原子級解析度!
“這是蛋白質顯微結構研究領域的一個巨大飛躍。”巴黎綜合理工學院生物化學家、電子顯微鏡專家皮埃爾-達米安·庫勒(Pierre-Damien Coureux)歡呼道。德國馬普生物物理化學研究所的霍爾格·施塔克(Holger Stark)是實現該突破的主角之一,他認為“提高解析度的終極障礙已被克服”。
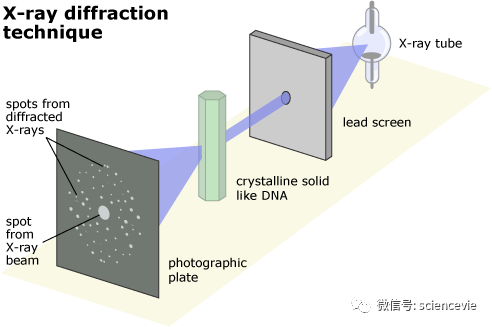
其實,人們早已“見過”原子了:1950年代起,X射線晶體學就實現了原子的視覺化。然而,這只是一種間接方法:透過對X射線照射樣品建立的衍射影象進行處理和解釋,研究人員可重建樣品的分子結構。
此外,該技術只能用於可形成晶體的化學物質的研究,也就是那些原子排列規則的固體——儘管大多數礦物(鹽、水……)都滿足此要求,但許多活性分子(例如蛋白質)卻是不規則的。
最後,X射線晶體學的最大不足就是缺乏強制冷凍蛋白質的技術。
重現分子運動
然而,蛋白質分子的主要特徵是“極易彎曲,始終處於運動狀態”,雅克·杜博歇(Jacques Dubochet)評論道。
因發展了冷凍電鏡技術,這位瑞士洛桑大學榮譽教授與美國哥倫比亞大學的約阿希姆·弗蘭克(Joachim Frank)、英國劍橋大學的理查德·亨德森(Richard Henderson)榮膺2017年諾貝爾化學獎。
阿希姆·弗蘭克(Joachim Frank)
40年前,杜博歇在觀察蛋白質的自然排列時發明了冷凍電鏡。他找到了一種將蛋白質封入“玻璃態水”(低密度無定形冰)中而凍結其運動的方法:人們由此觀察到了蛋白質與細胞質發生相互作用時的千姿百態。“如今,冷凍電鏡的解析度真的已經達到原子級。”這位已退休的研究人員自豪地總結道。
懸於低密度無定形冰中的 GroEL 蛋白。在水中純化蛋白質,然後將一片穿孔的膜浸入該蛋白質溶液,從而使蛋白質在其孔隙中伸展並充分勾勒出自身結構。最後,將所有物質浸入 -182℃的液態乙烷中。快速的冷卻過程使水以玻璃態凝結,如同一塊保護性的脈石般包裹著蛋白質。
低溫顯微鏡之所以必然是電子顯微鏡,是因為只有電子才能顯示出原子的輪廓,而光學顯微鏡中的可見光會繞過原子導致無法顯像。傳統共聚焦顯微鏡使用的可見光只能分辨間距不短於自身半個波長的兩個相鄰點,因此充其量只能區分200奈米的細節。
然而,原子的大小在0.1到1埃之間,是傳統光學顯微鏡解析度的萬分之一!波長短得多的電子束的尺寸能達到0.02埃。而電子顯微鏡的缺點在於,電子束帶有負電荷,會與樣品發生相互作用並切斷有機分子鍵,從而降低成像效果!
這是電子顯微鏡的經典技術:向樣品發射電子束,電子束透過樣品照射到閃爍體探測器上併發出光子,繼而被 CCD 相機檢測到。然而2013 年,能夠直接檢測電子的新型照相機徹底改變了這一過程。
另外,電子也非常敏感,任何干擾都會影響其運動。因此,只有當研究物件是純淨的化學物質且處於真空環境中,電子顯微鏡才能得到準確的影象。然而在真空環境中,蛋白質會被破壞。
因此迄今為止,蛋白質的透射電子顯微鏡影象一直都類似於半融化的蠟雕。長期以來,上述研究一直被批評者嘲諷為“斑點學”!
所幸近年來,難題已被一一解決:杜博歇將蛋白質固定在玻璃態水中的方法進行改進,可以防止蛋白質被電子和真空破壞;極細電子束的開發進一步減少了蛋白質的損壞,超精確相機實現了單電子探測,若干新演算法還校正了光學像差和其他畸變。
更重要的是,如今超級計算機的強大效能可以對收集於單個樣本的成千上萬張影象進行合成,從而展現出無與倫比的精確度。
要看清原子,僅靠一張照片是不夠的:相機從數百個角度記錄下數千張影象來獲取三維結構,並且記錄了樣品中成千上萬的分子。將所有資料合成單幅影象需要數週的計算。最重要的是,還需要一種基於化學結構和化學鍵排列方向機率的強大演算法,來提高影象精度。如今,這些程式甚至能夠區分樣品分子採用的各種構象。
水到渠成。2020年5月,馬普研究所霍爾格·施塔克團隊,以及劍橋大學MRC分子生物學實驗室的舍爾斯·謝雷斯(Sjors Scheres)和拉杜·阿里切斯庫(Radu Aricescu)團隊於同一天宣佈實現了原子級解析度。
這是人類首次分辨出分子中的原子!無巧不成書,這兩個團隊研究的是同一個大分子,即去鐵鐵蛋白。對致力於將冷凍電鏡解析度推向極限的結構生物學家來說,這種將鐵轉運到血紅蛋白的蛋白質確實是一種理想的試驗品。
“這是一個非常穩定且對稱的大分子。”舍爾斯·謝雷斯解釋說,“我們甚至透過冷凍電鏡看到了單個氫原子。”
“幾年來,我們對化學物質的感知已經從顯示化學物質的大概形態,發展到了原子級別的觀察。”皮埃爾-達米安·庫勒描述道,“這改變了生物學的一切。”
事實上,生命的活動建立於原子間的精妙相互作用:異性電荷相吸,同性電荷相斥,蛋白質像多極化的磁體一樣與受體結合。由此實現了諸如神經元之間的資訊傳遞,病毒入侵細胞,藥物阻斷有害效應……
核糖體的完整翻譯過程
“今後我們將能看到在活體環境中的蛋白質,觀察它們在與受體相互作用時是如何改變構象的。”瑞士巴塞爾大學的菲利普·蘭格萊(Philippe Ringler)興奮地表示,他正目睹冷凍電鏡勢不可擋的浪潮,“許多晶體學家在接受冷凍電鏡的操作培訓,而各所大學也開始逐步配備強大的成像裝置。”
微管是如何在細胞內轉運元素的?核糖體(上圖)是如何翻譯基因組的?線粒體是如何吞吐維持其機能所需的物質的?今後,生物學家將藉助電鏡看到運轉中的細胞工廠。
得益於該技術,2020年7月,美國馬薩諸塞大學的一個團隊從基因組的編碼入手,準確地描繪出細胞內蛋白質是如何“編織”在一起的。
在冷凍電鏡下放置了一些核糖體後,研究人員觀察到,這些由蛋白質和RNA組成的結構透過摺疊成精確的構型,形成若干空腔並在腔內插入了不同的部件:確保準確翻譯的基因組片段,以及將要組裝的蛋白質載體。隨著翻譯的進行,這些部件從一個腔傳遞到另一個腔。在前所未有的精度下,整個過程宛如一場由眾多分子共同扭動的芭蕾舞!
除此以外,還有更多利用冷凍電鏡原子級解析度的研究正在開展中。例如,透過識別出最適合嵌入受體的分子來加速藥物或疫苗的開發。在鑑別出COVID-19後的頭一個月,數十個團隊就製取了若干該病毒的冷凍電鏡影象來觀察其表面的分子,從而瞭解其附著在人類細胞中的具體位置。
隨後,這些影象可以幫助研究人員更快地識別出能夠阻止病毒附著、預防感染的候選藥物。還有研究試圖透過觀察神經遞質附著在膜受體上的過程,將神經訊號在神經元間傳遞的過程視覺化。
這樣一來就可以製造出針對癲癇、疼痛或戒斷髮作的靶向藥物。還有的研究希望能夠解釋在阿爾茨海默病患者的大腦中積聚的斑塊(參見下方圖示)……
阿爾茨海默病是由大腦中的澱粉樣沉積物所引起的,這些澱粉樣斑塊由蛋白質塊組成。解密其與腦細胞的相互作用以及它們在腦中的蔓延方式或許會開發新的治療途徑。
這只是冷凍電鏡原子革命的開始,卻也可以認為是一個完美的結束,因為該技術的解析度幾乎無法再提高了。“我認為冷凍電鏡的解析度能達到1.1甚至1埃。”舍爾斯·謝雷斯預測道,“不過為此糾正像差需要處理海量的資料。”
目前,研究人員的目標是將原子級解析度擴充套件到比去鐵鐵蛋白更復雜的分子。2020年初,冷凍電鏡三維分子結構資料庫已建檔10000組資料。在理查德·亨德森看來,到2024年,冷凍電鏡技術產生的研究資料或許會比X射線晶體學更多。
化學和生物學領域的一個全新局面正徐徐開啟。
撰文 Anne Debroise
編譯 周玉府
來源:新發現雜誌
編輯:just_iu