膀胱過度活動症(Overactive bladder,OAB)是一種常見的疾病,影響到10-15%的人口,在女性和老齡化人群中更為常見,產生大量的直接和間接醫療成本,佔全球醫療支出的數十億美元1。OAB被國際尿控協會定義為急迫性,伴有或不伴有急迫性尿失禁,通常伴有尿頻和夜尿症2。OAB是一種慢性疾病,只有一小部分患者的症狀能自行緩解3。
在過去的幾十年中,對OAB病因的瞭解已經取得部分進展,並且已經確定了一些潛在的OAB表型和病理機制。肌源性機制(將逼尿肌過度活動與OAB聯絡起來)可能是最為人所知的機制4。然而,在尿動力學研究中,只有一半患有OAB的女性逼尿肌過度活動。
一般來說,EAU及AUA指南建議初始保守干預和生活方式改變策略(如補充液體量、定時排尿和盆底運動),如果保守治療無法緩解症狀,則需要進行藥物干預。最早用於治療OAB的藥物是抗膽鹼能藥物,黃酮哌酯(flavoxate)和奧昔布寧(oxybutynin)分別於1970和1975年被FDA批准用於治療OAB5。隨著時間的推移,一些具有各種藥效學特性(仍被視為抗膽鹼能類的一部分)的額外藥物(如托特羅定、曲司氯胺、達非那新、索利那新和非索羅定)被開發並批准用於OAB患者。這些藥物阻斷膀胱中的膽鹼能受體,從而降低自發的膀胱肌細胞活動6。
在一項針對249名女性的高質量隨機對照研究中,索利那新治療組急迫性尿失禁(OAB伴尿失禁)的治癒率為13%。然而,只有10%的患者在一年後繼續接受藥物治療7。患者服用藥物依從性較低這種現象在一定程度上是由抗膽鹼能藥物相關的不良反應引起的,包括胃腸道、眼部、泌尿道、神經和心血管方面的影響8。許多特定副作用(如口乾和便秘)是眾所周知的,但大規模的、基於人群的觀察性研究表明,暴露於抗膽鹼能藥物也可能增加痴呆症的風險,這引起了一定的關注,因為它會使患者喪失相當大的獨立性,與發病率相關,併產生巨大的社會和醫療成本9,10。所以從患者的角度來看,認知障礙是抗膽鹼能藥物可怕的副作用。
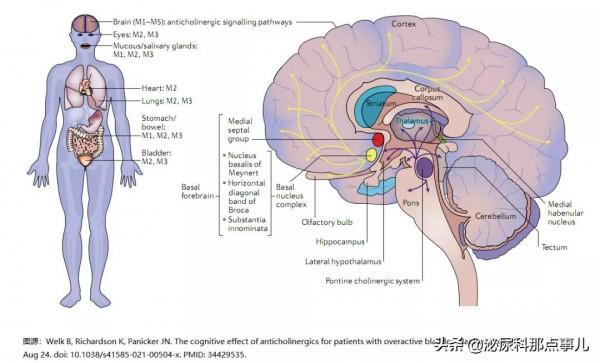
在中樞神經系統中,膽鹼能基底前腦產生乙醯膽鹼的神經元投射到新皮質、杏仁核和海馬結構,腦幹膽鹼能神經元投射到中腦和後腦11。膽鹼能神經迴路具有幾個重要功能,從學習、記憶、注意力和感覺運動處理等高階功能,到睡眠週期和覺醒等低階功能11,13。毒蕈鹼乙醯膽鹼受體(MACHR)的五種亞型(M1-M5)在不同的腦區表達,M1受體在海馬、額葉、顳葉、頂葉和枕葉新皮質中高度表達(其次是M2和M4亞型)14。mAChR表達水平在紋狀體中最高,M1和M4是最豐富的亞型。相比之下,在下尿路,最廣泛分佈的mAChR是M3亞型,儘管M2受體在功能上最相關15。
毒蕈鹼乙醯膽鹼受體(MACHR)位於多個器官中(如大腦、心臟、肺、腸道和膀胱)。MACHR有五個亞型,具有不同的作用:M1受體主要集中在中樞神經系統(CNS),M2受體主要集中在心臟,M3受體主要集中在平滑肌。M4和M5受體主要位於中樞神經系統,但其確切作用尚不清楚。在大腦中,主要的膽鹼能通路是基底前腦,包括基底核覆合體(黃色)、內側隔群(紅色)和腦橋膽鹼能系統(紫色),它們投射到丘腦和皮質的不同區域。
相關臨床研究表明,某些抗膽鹼能藥物發揮中樞神經系統作用的能力是透過拮抗mAChR的M1亞型,並在一定程度上拮抗M2和M4受體,導致中樞膽鹼能活性降低,膽鹼能功能和儲備功能的降低易導致認知能力受損,易感個體的記憶受損16,17。有幾個因素可能會增加中樞抗膽鹼能藥物不良反應的易感性,儘管這些因素到底是什麼尚不清楚。在14%的人群中發現載脂蛋白E(APOE)ε4等位基因是阿爾茨海默病的遺傳危險因素,對24名患者的初步研究表明,與沒有載脂蛋白E(APOE)ε4等位基因的患者相比,該等位基因攜帶者抗膽鹼能治療誘發記憶缺陷的風險增加18。在一項小型、單盲觀察研究中,短期服用抗膽鹼能藥物後出現的中樞不良反應,如簡易精神狀態檢查(MMSE)下降和行為改變在停藥後得到逆轉,這表明藥物暴露時間的長短可能會影響停藥後的可逆性19。
為了使抗膽鹼能藥物影響患者的認知功能,它們必須能夠直接與中樞神經系統相互作用。這種相互作用受藥效學特性的影響,藥效學特性決定了它們跨越血腦屏障的能力以及mAChR亞型在中樞神經系統中的分佈。
血腦屏障(BBB)透過阻止毒素進入並維持神經組織周圍的離子平衡來保護中樞神經系統。(B)BBB由毛細血管壁內皮細胞和環繞毛細血管的星形膠質細胞足以及毛細血管基底膜內的周細胞組成。(A)抗膽鹼能藥物的大小、親脂性和電荷等物理化學性質會影響其穿過血腦屏障的能力。例如,奧布昔寧是中性親油化合物,這有助於藥物透過BBB的被動擴散而進入中樞神經系統,而曲司氯銨具有離子電荷且親脂性差,而托特羅定和達非那新親脂性差且分子較大,這降低了這三類藥物透過BBB的擴散至中樞神經系統的藥物水平。(C)主動轉運機制(如存在於毛細血管內皮細胞的基底外側膜上的P-gp蛋白)主動將一些抗膽鹼能藥物(曲司氯銨、托特羅定及達非那新)移出大腦。
大多數其他OAB抗膽鹼藥對膀胱相關的mAChR是非選擇性的(如奧昔布寧、托特羅定、非索羅定),或僅是弱選擇性的(如索利那新)。在大鼠模型中,正電子發射斷層掃描顯示,奧昔布寧對中樞神經系統的mAChR拮抗作用最高,達非那星最低20。這些觀察結果對人類的影響尚不確定。年齡的增長、某些藥物的使用以及糖尿病、神經系統疾病和壓力等的存在都會影響BBB的被動通透性和主動轉運機制21。因此,在人類中,尤其是那些有以上相關疾病的患者(包括絕大多數OAB患者),所有抗膽鹼能藥物都應被認為具有穿過血腦屏障的潛力。腦組織病理學和神經影像學相關研究表明,抗膽鹼能藥物暴露與結構和功能改變之間存在關聯。在一項對居住在社群的老年人(平均年齡52歲)的研究中,與未使用抗膽鹼藥的人群相比,暴露於無已知臨床相關認知效應的抗膽鹼能藥物與總皮質灰質體積萎縮率更高相關。在認知正常的老年人中,使用抗膽鹼能藥物與腦萎縮增加有關,特別是在顳葉(主管在語言和記憶功能)22。
在閱讀有關認知功能與抗膽鹼能藥物相關的文獻時,區分認知障礙和痴呆症很重要。痴呆症是一種慢性綜合徵,其特徵是記憶力和其他認知功能或情緒控制能力下降,嚴重到足以造成社會和職業損害。相反,認知障礙是指客觀認知能力下降,超出了年齡和教育水平的預期,不足以干擾日常生活。從認知障礙進展為痴呆的患者比例各不相同,範圍為0.3-30%,然而,重要的區別在於認知障礙是可以逆轉的,而痴呆症則不是23。認知障礙是一個潛在的過程;參與記憶和注意的神經網路中膽鹼能活動的抑制在這些早期認知變化的發展中起著關鍵作用11。然而,支撐這些變化的確切機制目前尚不清楚。相比之下,痴呆症是一種特徵明確的疾病,具有特定的不可逆的病理變化23。
短期臨床研究未顯示除奧昔布寧的OAB抗膽鹼藥對認知功能有明顯損害。缺乏OAB抗膽鹼藥的長期臨床研究,可用的這些研究受到方法學問題的限制。認知障礙可能是可逆的,或者患者可能能夠補償短期損害後的變化,這解釋了短期和長期研究結果之間的一些差異。相比之下,越來越多的觀察性研究表明,暴露於用於OAB症狀的抗膽鹼能藥物與未來痴呆診斷之間存在直接聯絡。長期使用OAB抗膽鹼能藥物(尤其是90天)的患者,痴呆相關風險增加20%24。但不能排除殘留的混淆和反向因果關係(在這種情況下,某些抗膽鹼能藥物被用於治療痴呆症的早期症狀或前驅症狀)。評估新型抗膽鹼藥認知效應的前瞻性短期臨床研究結果明顯不一致,評估痴呆症的大型觀察性研究可能是因為在評估痴呆症風險的觀察性研究中,OAB藥物亞組中使用奧昔布寧的比例較高。在臨床試驗中短期使用新型OAB抗膽鹼能藥物(大部分持續時間為4周或更短)可能不足以導致認知改變。在現實環境中接受抗膽鹼能藥物治療的患者型別(並且是管理資料研究的基礎)可能與前瞻性認知臨床試驗中的患者不同。此外,許多隨機臨床試驗排除了聯合服用其他抗膽鹼能藥物,在現實環境中,這些藥物可能會增強OAB抗膽鹼能藥物對認知的影響9。
抗膽鹼能藥物是OAB治療的一線選擇之一,基於這些藥物對認知和痴呆影響的文獻的總體共識提高了在某些患者群體中開處方時的謹慎性:
65歲以下認知功能正常的患者:
- 考慮抗膽鹼能藥物或β3受體激動劑作為OAB的治療選擇
65歲以上認知能力正常的患者:
- 如果醫學上合適的話,考慮β3受體激動劑作為初始口服藥物治療
- 在大多數情況下避免使用奧昔布寧,如果仍需要,則使用低劑量、緩釋製劑
- 考慮具有較好的理化性質和臨床認知安全性證據的OAB抗膽鹼能藥物(如達非那新、曲司氯胺或非索羅定)作為口服治療OAB藥物的選擇
潛在高危人群(高危人群包括有可能發展為認知障礙的神經系統疾病患者和虛弱或疑似輕度認知障礙的患者):
- 如果醫學上合適的話,考慮β3受體激動劑作為初始口服藥物治療
- 在大多數情況下避免使用奧昔布寧,如果仍需要,則使用低劑量、緩釋製劑
- 考慮具有較好的理化性質和臨床認知安全性證據的OAB抗膽鹼能藥物(如達非那新、曲司氯胺或非索羅定)作為口服治療OAB藥物的選擇
- 考慮可替代的OAB治療方式(如骶神經調節或膀胱內注射肉毒桿菌毒素)是否可能優於OAB抗膽鹼能藥物治療
已存在的認知障礙或痴呆的患者:
- 如果醫學上合適的話,考慮β3受體激動劑作為初始口服藥物治療
- 避免使用奧昔布寧
- 醫學上合適的低劑量的OAB抗膽鹼藥,具有較好的理化性質和臨床認知安全性證據(如達非那新、曲司氯胺或非索羅定)並被認為對患者的生活質量很重要,則可被視為OAB患者口服藥物的治療選擇
--考慮總抗膽鹼能藥物負擔
--需要篩選排除出主觀記憶問題和跌倒的患者
--請護理人員監測認知和功能變化。如果可能,臨床醫生應使用已應用於實踐的認知障礙量表
- 考慮可替代的OAB治療方式(如骶神經調節或膀胱內注射肉毒桿菌毒素)是否可能優於OAB抗膽鹼能藥物治療
關於OAB抗膽鹼藥和認知改變的主題雖然已經進行了廣泛的研究,但重要的問題仍然沒有答案。先進的技術,如功能磁共振成像,可以幫助我們瞭解口服OAB抗膽鹼藥如何影響認知任務期間的功能變化,並透過提供可測量的認知變化標誌物,對這些藥物引起的認知損害的可逆性提供見解25。想要進一步瞭解長期使用OAB抗膽鹼能藥物對認知的影響和高危人群的危險程度,需要更多的前瞻性臨床試驗研究。先前的研究已經確定了男性和女性之間抗膽鹼能引起的認知變化的風險程度不同(可能是由於雌激素的神經保護作用)26,27,這種結果的差異應該進行前瞻性研究進一步驗證。其他具有內在潛在抗膽鹼能相互作用的患者群體,如具有APOE-ε4等位基因的患者,可以透過結合遺傳登記和管理資料進行研究。OAB本身可能是神經退行性變的早期徵兆28,先於認知障礙,這種可能性強調了在未來的研究中密切匹配對照組OAB藥物適應症的重要性。最後,抗膽鹼能相關的認知變化是否會隨著停藥而可逆,是否會增加未來認知障礙或痴呆的風險尚不清楚。這一概念尤其重要,因為許多人只在短時間內使用OAB抗膽鹼藥29。
【參考文獻】
1.Milsom, I. et al. Global prevalence and economic burden of urgency urinary incontinence: a systematic review. European urology 65, 79-95, doi:10.1016/j.eururo.2013.08.031 (2014).
2.Abrams, P. et al. The standardisation of terminology in lower urinary tract function: report from the standardisation sub-committee of the International Continence Society. Urology 61, 37-49, doi:10.1016/s0090-4295(02)02243-4 (2003).
3.Heidler, S. et al. The natural history of lower urinary tract symptoms in females: analysis of a health screening project. European urology 52, 1744-1750, doi:10.1016/j.eururo.2007.08.007 (2007).
4.Peyronnet, B. et al. A Comprehensive Review of Overactive Bladder Pathophysiology: On the Way to Tailored Treatment. European urology 75, 988-1000, doi:10.1016/j.eururo.2019.02.038 (2019).
5.Hesch, K. Agents for treatment of overactive bladder: a therapeutic class review. Proceedings (Baylor University. Medical Center) 20, 307-314, doi:10.1080/08998280.2007.11928310 (2007).
6.Leone Roberti Maggiore, U. et al. Pharmacokinetics and toxicity of antimuscarinic drugs for overactive bladder treatment in females. Expert opinion on drug metabolism & toxicology 8, 1387-1408, doi:10.1517/17425255.2012.714365 (2012).
7.Visco, A. G. et al. Anticholinergic therapy vs. onabotulinumtoxina for urgency urinary incontinence. The New England journal of medicine 367, 1803-1813, doi:10.1056/NEJMoa1208872 (2012).
8.Kessler, T. M. et al. Adverse event assessment of antimuscarinics for treating overactive bladder: a network meta-analytic approach. PloS one 6, e16718, doi:10.1371/journal.pone.0016718 (2011).
9.Coupland, C. A. C. et al. Anticholinergic Drug Exposure and the Risk of Dementia: A Nested Case-Control Study. JAMA internal medicine 179, 1084-1093, doi:10.1001/jamainternmed.2019.0677 (2019).
10.Anticholinergic drugs and risk of dementia: case-control study. BMJ (Clinical research ed.) 367, l6213, doi:10.1136/bmj.l6213 (2019).
11.Marzoughi, S. et al. Tardive neurotoxicity of anticholinergic drugs: A review. Journal of neurochemistry 158, 1334-1344, doi:10.1111/jnc.15244 (2021).
12.Conn, P. J., Jones, C. K. & Lindsley, C. W. Subtype-selective allosteric modulators of muscarinic receptors for the treatment of CNS disorders. Trends in pharmacological sciences 30, 148-155, doi:10.1016/j.tips.2008.12.002 (2009).
13.Lebois, E. P., Thorn, C., Edgerton, J. R., Popiolek, M. & Xi, S. Muscarinic receptor subtype distribution in the central nervous system and relevance to aging and Alzheimer's disease. Neuropharmacology 136, 362-373, doi:10.1016/j.neuropharm.2017.11.018 (2018).
14.Carithers, L. J. & Moore, H. M. The Genotype-Tissue Expression (GTEx) Project. Biopreservation and biobanking 13, 307-308, doi:10.1089/bio.2015.29031.hmm (2015).
15.Hersch, S. M. & Levey, A. I. Diverse pre- and post-synaptic expression of m1-m4 muscarinic receptor proteins in neurons and afferents in the rat neostriatum. Life sciences 56, 931-938, doi:10.1016/0024-3205(95)00030-a (1995).
16.Messer, W. S., Jr., Bohnett, M. & Stibbe, J. Evidence for a preferential involvement of M1 muscarinic receptors in representational memory. Neuroscience letters 116, 184-189, doi:10.1016/0304-3940(90)90407-z (1990).
17.Anagnostaras, S. G. et al. Selective cognitive dysfunction in acetylcholine M1 muscarinic receptor mutant mice. Nature neuroscience 6, 51-58, doi:10.1038/nn992 (2003).
18.Pomara, N., Willoughby, L. M., Wesnes, K. & Sidtis, J. J. Increased anticholinergic challenge-induced memory impairment associated with the APOE-epsilon4 allele in the elderly: a controlled pilot study. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology 29, 403-409, doi:10.1038/sj.npp.1300305 (2004).
19.Jewart, R. D., Green, J., Lu, C. J., Cellar, J. & Tune, L. E. Cognitive, behavioral, and physiological changes in Alzheimer disease patients as a function of incontinence medications. The American journal of geriatric psychiatry : official journal of the American Association for Geriatric Psychiatry 13, 324-328, doi:10.1176/appi.ajgp.13.4.324 (2005).
20.Callegari, E. et al. A comprehensive non-clinical evaluation of the CNS penetration potential of antimuscarinic agents for the treatment of overactive bladder. British journal of clinical pharmacology 72, 235-246, doi:10.1111/j.1365-2125.2011.03961.x (2011).
21.Starr, J. M. et al. Increased blood-brain barrier permeability in type II diabetes demonstrated by gadolinium magnetic resonance imaging. Journal of neurology, neurosurgery, and psychiatry 74, 70-76, doi:10.1136/jnnp.74.1.70 (2003).
22.Chuang, Y. F., Elango, P., Gonzalez, C. E. & Thambisetty, M. Midlife anticholinergic drug use, risk of Alzheimer's disease, and brain atrophy in community-dwelling older adults. Alzheimer's & dementia (New York, N. Y.) 3, 471-479, doi:10.1016/j.trci.2017.06.004 (2017).
23.Plassman, B. L. et al. Incidence of dementia and cognitive impairment, not dementia in the United States. Annals of neurology 70, 418-426, doi:10.1002/ana.22362 (2011).
24.Welk, B. & McArthur, E. Increased risk of dementia among patients with overactive bladder treated with an anticholinergic medication compared to a beta-3 agonist: a population-based cohort study. BJU international 126, 183-190, doi:10.1111/bju.15040 (2020).
25.High, R. A. et al. Protocol for a multicenter randomized, double blind, controlled pilot trial of higher neural function in overactive bladder patients after anticholinergic, beta-3 adrenergic agonist, or placebo. Contemporary clinical trials communications 19, 100621, doi:10.1016/j.conctc.2020.100621 (2020).
26.Richardson, K. et al. Use of Medications with Anticholinergic Activity and Self-Reported Injurious Falls in Older Community-Dwelling Adults. Journal of the American Geriatrics Society 63, 1561-1569, doi:10.1111/jgs.13543 (2015).
27.Rahman, A. et al. Sex and Gender Driven Modifiers of Alzheimer's: The Role for Estrogenic Control Across Age, Race, Medical, and Lifestyle Risks. Frontiers in aging neuroscience 11, 315, doi:10.3389/fnagi.2019.00315 (2019).
28.Sakakibara, R. et al. Is overactive bladder a brain disease? The pathophysiological role of cerebral white matter in the elderly. International journal of urology : official journal of the Japanese Urological Association 21, 33-38, doi:10.1111/iju.12288 (2014).
29.Sexton, C. C. et al. Persistence and adherence in the treatment of overactive bladder syndrome with anticholinergic therapy: a systematic review of the literature. International journal of clinical practice 65, 567-585, doi:10.1111/j.1742-1241.2010.02626.x (2011).