作為代謝領域的“神藥”,二甲雙胍或許算是最著名的“斜槓藥”了。不論是降糖還是減肥,甚至是抗衰老抗腫瘤延長壽命,二甲雙胍都能發揮或大或小的作用。
近日,科學家又發現了二甲雙胍的一項新工作:影響脂肪細胞的細胞週期。
理論上講,作為一種高度分化的細胞,人類脂肪細胞無法進行有絲分裂,也就不應該存在所謂的細胞週期。然而,脂肪細胞卻能實現近200倍的體積增長,並加速炎症細胞因子釋放。這其中的奧秘至今仍未研究清楚。
近年來,有研究表明人體內多種細胞型別都使用核內複製來實現體積的大幅度增加[1]。核內複製是一種特殊的細胞週期,進入核內複製的細胞持續多輪進行DNA複製,促進細胞生長但不發生胞質分裂[2]。而脂肪細胞是否擁有類似的機制仍不得而知。
為了確定脂肪細胞體積增大與細胞週期的關係,來自瑞典斯德哥爾摩卡羅林斯卡學院細胞與分子生物學系的Kirsty L. Spalding教授團隊採用接受腹部手術患者的新鮮分離脂肪組織進行研究。經過一系列分析驗證,研究人員發現人類脂肪細胞中存在細胞週期特異基因的表達,肥胖與高胰島素血癥能促進細胞週期的進展,同時伴隨細胞大小和DNA含量的增加。
慢性高胰島素血癥能導致脂肪細胞過早衰老並釋放大量炎症細胞因子,二甲雙胍透過影響脂肪細胞細胞週期減緩脂肪細胞衰老過程。相關工作發表於《自然·醫學》中[3]。
在介紹文章之前,我們先來複習一下細胞週期。
細胞週期是指細胞從一次分裂完成開始到下一次分裂結束所經歷的全過程,分為間期與分裂期兩個階段。其中,分裂間期又分為DNA合成前期(G1期),DNA合成期(S期)和DNA合成後期(G2期),分裂期則分為前中後末四期。
理論上說,成熟的脂肪細胞中不應存在細胞週期的啟用。
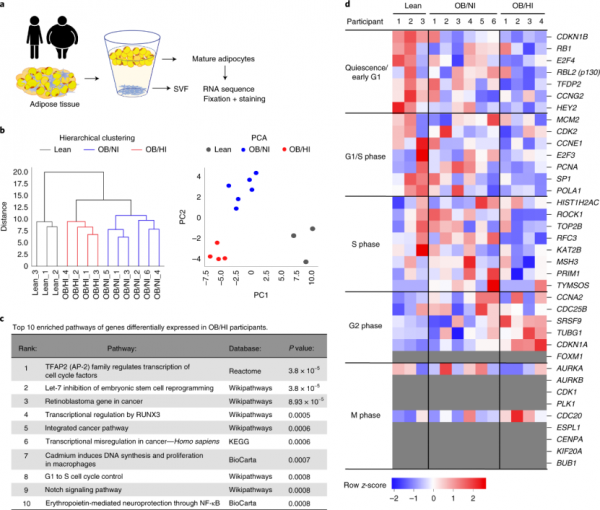
研究人員選擇接受腹部手術患者的成熟腹部皮下脂肪組織進行RNA-seq分析。受試者分為BMI<30kg/m2的不胖個體(lean,以下簡稱不胖組),BMI≥30kg/m2但不伴高胰島素血癥的單純肥胖個體(OB/NI,以下簡稱純胖組)和BMI≥30kg/m2且伴高胰島素血癥的個體(OB/HI,以下簡稱高胰胖組)。
透過無監督聚類分析,研究人員驚奇的發現,肥胖個體中差異基因居然主要富集在細胞週期進入及進展相關基因,後續qPCR檢測也驗證了這一結果。
對特定細胞週期階段相關基因進行分析後,研究人員發現不同組別的受試者基因表達存在很大的差異。不胖組主要表達G1期相關基因,純胖組整個細胞週期基因表達都較活躍,而高胰胖組的G1與S期相關基因表達較低,但G2期相關基因表達卻明顯增高。
同時,三組脂肪組織細胞分裂期相關基因均幾乎不表達,說明脂肪組織雖然激活了細胞週期,但並不進行分裂。
既然三組受試者的細胞週期相關蛋白表達情況如此不同,是否意味著胰島素在脂肪細胞細胞週期的進展中起了重要作用呢?
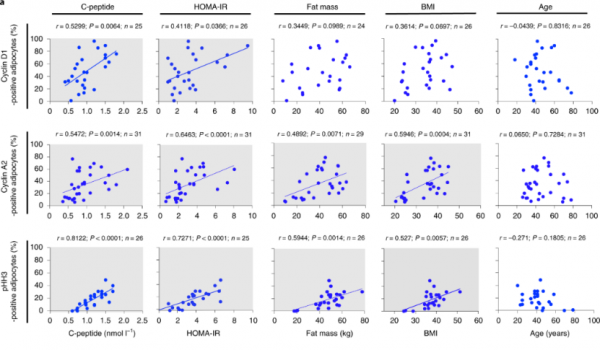
為了驗證這一猜想,研究人員對受試者的臨床特徵(包括年齡,BMI,C肽,脂肪量,HOMA-IR等)與細胞週期標誌物進行了詳細分析。與預期結果相同,研究人員發現肥胖和胰島素相關引數(C肽及HOMA-IR)與細胞週期標誌物之間存在很強的相關性。
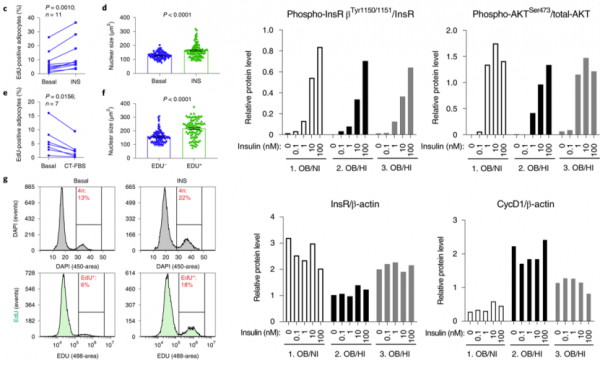
為了進一步驗證胰島素的功能,研究人員提取新鮮分離的人脂肪細胞進行培養,根據培養基中是否額外新增胰島素將細胞分為不新增胰島素組(Basal組)和新增胰島素組(INS組)。
經過4天的培養後,研究人員發現,新增胰島素組(INS組)DNA合成明顯增加,細胞及細胞核核也明顯增大。對兩組細胞進行流式細胞分選試驗也得到了相同的結果。
研究人員又對脂肪細胞中胰島素受體訊號下游通路相關蛋白表達情況進行了驗證,發現肥胖和高胰島素血癥均能啟用胰島素受體訊號通路,同時,高胰胖組細胞有更高的細胞週期相關蛋白表達。
有研究表明,脂肪細胞體積增大後會提前進入衰老,造成大量炎症細胞因子的釋放[4],但仍不清楚具體是什麼原因導致了脂肪細胞提前衰老。
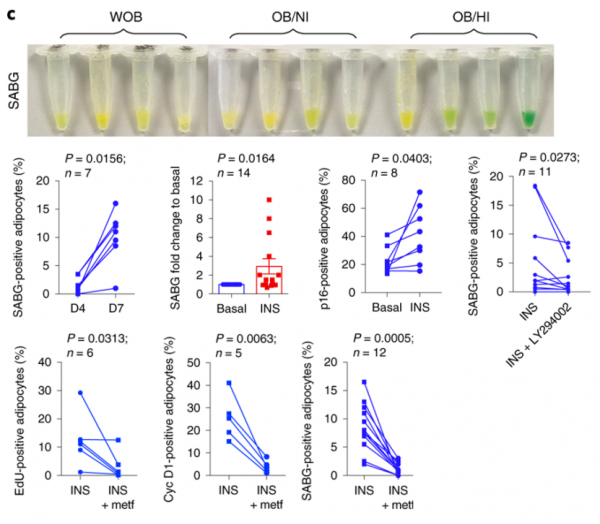
為了研究這一現象,研究人員將三組受試者的脂肪細胞進行衰老相關標記染色(SABG),令人驚奇的是,不胖組與純胖組SABG表達沒有明顯差異,而高胰胖組的SABG表達明顯升高。這說明是人類脂肪細胞衰老可能是由於高胰島素血癥介導的,而不是因為肥胖。
為了進一步研究胰島素對於脂肪細胞衰老的作用,研究人員再次將新鮮分離的脂肪細胞進行體外培養,並以不同的處理方式處理細胞。
與預期結果相同,新增胰島素的脂肪細胞SABG表達明顯升高,而加入PI3K(胰島素受體訊號通路中的關鍵蛋白)抑制劑LY294002則可以抑制胰島素的作用。
作為代謝領域的“神藥”,二甲雙胍在降糖和降脂方面都有不錯的表現。研究人員在接受胰島素刺激的脂肪細胞中新增二甲雙胍,發現二甲雙胍能夠逆轉胰島素帶來的細胞週期啟用,並緩解脂肪細胞衰老。這為二甲雙胍改善代謝提供了又一項證據。
隨著肥胖率在世界範圍內持續上升,人類代謝性疾病的發病率也隨之上升。為了更好的開發治療策略,詳細研究疾病的發病機制是非常有必要的。
本文的研究者首次報道了人類脂肪細胞的一個未被關注的特性,脂肪細胞週期的存在,並詳細介紹了高胰島素血癥如何啟用脂肪細胞週期並導致細胞衰老和炎症因子釋放。同時,提出了二甲雙胍改善代謝的新機制。這對今後肥胖相關疾病的治療有非常重要的參考價值。
參考文獻:
1. Edgar BA, Zielke N, Gutierrez C. Endocycles: a recurrent evolutionary innovation for post-mitotic cell growth. Nat Rev Mol Cell Biol. 2014 Mar;15(3):197-210. doi: 10.1038/nrm3756. Erratum in: Nat Rev Mol Cell Biol. 2014 Apr;15(4):294. PMID: 24556841.
2. Gandarillas A, Molinuevo R, Sanz-Gómez N. Mammalian endoreplication emerges to reveal a potential developmental timer. Cell Death Differ. 2018 Mar;25(3):471-476. doi: 10.1038/s41418-017-0040-0. Epub 2018 Jan 19. PMID: 29352263; PMCID: PMC5864232.
3. Li Q, Hagberg CE, Silva Cascales H, Lang S, Hyvönen MT, Salehzadeh F, Chen P, Alexandersson I, Terezaki E, Harms MJ, Kutschke M, Arifen N, Krämer N, Aouadi M, Knibbe C, Boucher J, Thorell A, Spalding KL. Obesity and hyperinsulinemia drive adipocytes to activate a cell cycle program and senesce. Nat Med. 2021 Oct 4. doi: 10.1038/s41591-021-01501-8. Epub ahead of print. PMID: 34608330.
4. Skurk T, Alberti-Huber C, Herder C, Hauner H. Relationship between adipocyte size and adipokine expression and secretion. J Clin Endocrinol Metab. 2007 Mar;92(3):1023-33. doi: 10.1210/jc.2006-1055. Epub 2006 Dec 12. PMID: 17164304.