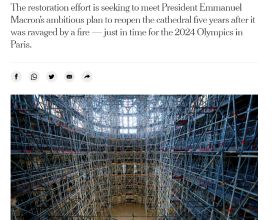
韓國首爾和馬里蘭州銀泉市2021年10月29日 /美通社/ -- 專門開發罕見肌肉骨骼疾病新藥的ImmunoForge公司(聯席執行長Sung-Min Ahn和Kiho Chang)報告說,他們正在開發的用於治療杜氏肌營養不良(DMD)和多發性肌炎(PM)的候選新藥PF1801已獲得美國食品及藥物管理局(FDA)的孤兒藥資格認定(ODD),用於治療多發性肌炎。
FDA將治療罕見的不治之症或危及生命的疾病的治療方案認定為“孤兒藥”獲得“孤兒藥”認定後,ImmunoForge將可享受多種優惠,比如免除NDA/BLA申請費、對符合條件的臨床試驗實行稅收減免,以及在批准上市後享有七年的獨家權利。
多發性肌炎是一種肌肉因炎症反應而變弱的疾病該病的病因尚未明確杜氏肌營養不良是一種罕見病,由一種名為Dystrophin(肌營養不良蛋白)的基因的缺失或改變而引起該病患者(通常是年輕男孩)會出現肌肉流失,最終導致死亡ImmunoForge公司聯席執行長Sung-Min Ahn博士指出:“這款孤兒藥的認定對於確認PF1801作為罕見肌肉骨骼疾病療法的潛力具有重大意義,我們希望它與我們正在開發的各種新藥一起,成為罕見病患者的希望源泉”
這是ImmunoForge第二次從FDA獲得PF1801的孤兒藥資格認定去年,他們獲得了PF1801治療杜氏肌營養不良和多發性肌炎適應症的“孤兒藥”稱號,他們目前正在準備與日本合作伙伴召開PMDA pre-IND會議,並且在討論在今年內推進許可合同和技術轉讓。
ImmunoForge最近完成了來自幾家投資開發公司的B輪融資,並且正在準備生產PF1801明年初在國外進入二期臨床研究所需的臨床試驗藥物,同時根據開發時間表為FDA的IND審批准備資料。
ImmunoForge還在美國設有分公司,並透過聘用Jim Ballance博士擔任美國分公司總裁加強了其全球競爭力Jim Ballance博士曾在PF1801的最初開發商PhaseBio公司擔任過副總裁。
ImmunoForge是一家由Gachon University Gil Hospital(韓國嘉川大學吉爾醫院)Gachon Genetic Science Research Institute(嘉川遺傳科學研究所)所長Sung-min Ahn博士和Kiho Chang於2017年共同創立的公司Kiho Chang曾在Dong-A Pharmaceuticals (KRX: 000640)、LG Life Sciences (KRX: 051910)和Anguk Pharmaceutical (KRX: 001540)等公司開發新藥並積累了超過25年的全球技術轉讓經驗公司的目標是在罕見肌肉骨骼疾病領域發展成為像Alexion這樣的世界級公司ImmunoForge聯席執行長Kiho Chang表示:“基於最近的B輪融資和美國FDA的孤兒藥資格認定,ImmunoForge將推動新藥的全球臨床開發和全球技術轉讓,併力爭在2023年之前在KOSDAQ上市ImmunoForge將發展成為目前缺乏有效療法的罕見肌肉骨骼疾病領域的全球生物風投企業”