成纖維細胞生長因子受體(FGFR)屬於酪氨酸激酶受體超家族成員中的一個亞族,由四種高度保守的跨膜受體酪氨酸激酶(FGFR1~4)和一種能夠結合成FGF配體但缺乏細胞內激酶結構域的受體FGFR5(也稱為FGFRL1)組成[1]。
成纖維細胞生長因子(FGF)作為FGFR的配體家族,由22個功能不同的配體組成,其中18個配體可與FGFR1~4受體結合,引起受體二聚化並使酪氨酸激酶結構域發生磷酸化,從而啟用下游訊號傳導通路,包括RAS/MAPK、FRS2/PI3K/AKT 及PLC-γ /PKC 等通路(圖 1)。這些訊號傳導途徑在多種生理過程如細胞增殖、分化、遷移和凋亡中均起著至關重要的作用[2-3]。
參考資料[1]
FGFR容易受到各種體細胞畸變的影響,發生過表達、點突變、基因易位等常見突變,從而導致癌變。基因擴增導致的FGFR過表達、FGFR EC區域(胞外結構域)/TK區域(激酶結構域)突變、FGFR融合等都會造成FGFR的訊號失調,從而促進了腫瘤細胞的增殖、存活、侵襲、轉移、和耐藥性的發展,以及腫瘤微環境(TME)血管生成和免疫逃避的發生[4]。因此,靶向FGFR的藥物已經成為腫瘤治療的重要手段。
FGFR抑制劑的“不限瘤種”療法潛力
FGFR基因變異通常在肺癌、肝癌、肝內膽管癌、乳腺癌、胃癌、子宮癌及膀胱癌等實體瘤中廣泛存在,並且不同癌種的FGFR突變型別及頻率也存在差異。
British Journal of Cancer volume 124, pages880–892
2015年發表在Clinical Cancer Research的一篇文章中,研究者透過下一代測序技術分析了4853例實體瘤患者FGFR變異情況。FGFR變異可見於7.1%(360/4853)的腫瘤樣本中,其中66%為基因擴增、26%為基因突變,8%為染色體重排。FGFR1變異率遠高於其它3種亞型,佔49%,FGFR2變異率為19%,FGFR3和FGFR4分別佔26和7%,並且約有5%患者存在1種以上FGFR亞型變異[5]。
FGFR抑制劑透過阻斷FGFR介導的訊號通路,達到抑制腫瘤生長的目,使其成為癌症靶向治療的新選擇。鑑於FGFR的泛瘤種表達,FGFR抑制劑具備成為“不限癌種”療法的潛力。
FGFR靶向藥物開發,從泛抑制劑開始
多靶點TKIs的開發為患者帶來臨床獲益,但是這類藥物是否能夠在臨床上充分抑制FGFR充滿不確定性。為了增強對攜帶FGFR變異患者的腫瘤靶向抑制作用以及減少多靶點TKIs相關毒性,科研人員最初的思路是開發泛FGFR抑制劑[6]。
全球首款獲得FDA批准的泛FGFR抑制劑為強生的厄達替尼(2019/4/13獲批),用於攜帶易感FGFR2或FGFR3基因變異的區域性晚期或轉移性尿路上皮癌患者,成為FDA批准的首款針對此類患者的靶向療法。
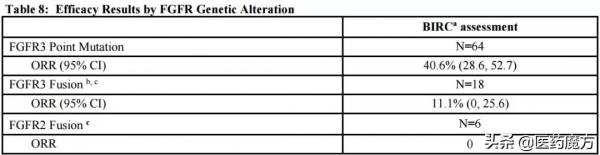
在包含87例存在FGFR3基因突變、FGFR3或FGFR2基因融合膀胱癌患者的開放標籤、單臂II期試驗中,獨立審查委員會(BIRC)評估的ORR為32.2%,其中CR為2.3%,PR為29.9%。中位DoR為 5.4 個月。從FGFR變異型別上看,64例FGFR3點突變患者ORR為40.6%;18例FGFR3基因融合患者ORR為11.1%;6例FGFR2基因融合患者ORR為0%。說明,FGFR3變異患者是受益人群。
厄達替尼上市後的銷售額並未見強生財報披露,有可能是表現不佳,這或許跟侷限於特定人群的二線用藥有關,不過卻證明了泛FGFR抑制劑的成藥性,鼓舞了同行,讓大家將FGFR抑制劑的應用拓展瞄向了膀胱癌之外的更多領域。
聚焦肝膽:泛FGFR抑制劑實現更大突破
相較於膀胱癌,肝癌和膽管癌患者攜帶FGFR基因變異的比例並不是最高的,但是這兩大癌種的臨床治療進展相對緩慢,索拉非尼一直佔據肝癌一線治療地位,多年來小分子單藥鮮有突破,存在迫切的需求。由此研發人員也將目光落在了FGFR抑制劑上,包括針FGFR的多靶點抑制劑。
比如,瑞戈非尼(FGFR / PDGFR / VEGFR / SCFR / BRAF多靶點抑制劑)的上市滿足了肝癌二線小分子靶向藥物的治療需求,侖伐替尼(FGFR / PDGFR / VEGFR / RET / SCFR多靶點抑制劑)更是在一線中擊敗索拉非尼,打破了索拉非尼的壟斷地位,也算是繼續奠定FGFR多靶點藥物在肝癌中的優勢。另一款FGFR多靶點抑制劑索凡替尼雖然選擇神經內分泌腫瘤作為首發適應症,但緊接著也是將膽道癌作為了第二階段臨床開發的重要選擇。
在膽管癌中,導致FGF/FGFR訊號通路異常啟用的原因多為FGFR融合突變。據報道,FGFR2融合或重排幾乎只發生在肝內膽管癌中,可在10-16%的患者中觀察到[7-9]。膽管癌目前的標準治療選擇有限,五年生存率僅為9%。尤其針對吉西他濱/順鉑治療失敗的患者,缺少有效的治療方法,二線治療的ORR通常低於10%,mPFS約為3個月,mOS為6~7個月。這些患者很有可能對FGFR抑制治療敏感,藥物的臨床試驗也證實了這一觀點。包括Incyte/信達開發的培美替尼(Pemigatinib)、BridgeBio公司開發的infigratinib,這兩款泛FGFR抑制劑先後獲得FDA批准,均是用於治療膽管癌。
培美替尼對FGFR1-3具有高抑制活性(IC50分別為0.4,0.5,和1nM),對 FGFR4 的活性較弱(IC50=30nM)。在107例FGFR2融合或重排患者中開展的II期研究中,培美替尼單藥治療的總緩解率為36%,中位DOR為9.1個月。該產品已於2020年4月獲FDA加速批准,用於接受過治療的攜帶FGFR2基因融合或重排的區域性晚期或轉移性膽管癌患者,是FDA批准的首款FGFR1-3抑制劑,同時也是FDA批准的首個膽管癌靶向療法。信達擁有在大中華區的開發和商業化權利,已於今年7月9日中國大陸申報上市並獲得了CDE優先審評資格,有望成為國內首個上市的選擇性FGFR抑制劑。
Infigratinib是FDA批准的第2款FGFR 1-3抑制劑,適應症與Pemigatinib相同,108例受試者中的ORR為23.1%,DOR為5.0個月。另外侖勝醫藥/Basilea的德拉替尼在治療膽管癌的II期研究中也取得積極結果,ORR為20.7%。
FGFR抑制劑升級:從“泛”到“專”
泛FGFR抑制劑以及FGFR1-3抑制劑的開發都取得了成功;但是,因為抑制FGFR1導致的高磷血癥不良反應以及耐藥性問題也引起了研發人員的重視。因此,多家企業致力於開發靶向FGFR2、FGFR3、FGFR4精準亞型的高選擇抑制劑和克服現有FGFR抑制劑耐藥的第二代FGFR抑制劑。比如針對FGFR2,安進/再鼎、Relay 、Galaxy Biotech、第一三共均在開發單抗類藥物,拜耳則在同步開發單抗和ADC藥物。
安進/再鼎醫藥開發的bemarituzumab是一款靶向FGFR2b的first in class亞型選擇性人源化單克隆抗體。它不僅可阻斷FGFR2b與FGFs配體(FGF7, FGF10和FGF22)結合,抑制FGFR2b的啟用,從而抑制若干下游通路,還可透過募集自然殺傷細胞,增強抗體依賴性細胞介導的細胞毒作用(ADCC)直接殺死腫瘤細胞。bemarituzumab的特點是不會抑制代謝相關的FGF23(FGFR1的配體),因此避免了泛FGFR抑制劑相關的高磷血癥風險[10]。基於一項名為FIGHT的一線治療FGFR2b陽性、區域性晚期或轉移性胃癌和胃食管交界處癌患者的II期臨床研究資料,bemarituzumab先後獲得了美國FDA和NMPA的突破性療法認定,該藥物目前也是開發進展最快的FGFR2抑制劑。
成人體內FGF19配體主要作用於肝臟,能夠抑制膽汁酸合成,調節膽汁酸穩態,參與葡萄糖、脂質和能量穩態的調節等。但過表達的FGF19與其受體FGFR4結合可導致FGFR4訊號通路過度啟用,從而誘發肝細胞癌的發展。因此,有不少企業致力於開發專門用於肝細胞癌的高選擇性FGFR4抑制劑。
fisogatinib(BLU-554)是一款選擇性FGFR4抑制劑,由基石藥業從Blueprint Medicines引進。針對HCC 的I期研究(NCT02508467)結果顯示,在不同劑量下,FGF19 陽性患者的ORR為17% [中位緩解持續時間:5.3個月(95% CI,3.7-未達到)],FGF19陰性患者的ORR為0%。此外,雲頂新耀擁有全球權益roblitinib、和譽醫藥的ABSK011、首藥控股的SY-4798、諾誠健華的ICP-105等,同樣也是選擇性的FGFR4抑制劑。
TYRA-30由Tyra Biosciences開發,是一種選擇性FGFR3抑制劑,主要克服現有FGFR抑制劑的兩大缺陷:(1)克服V555 gatekeeper突變引起耐藥;(2)選擇性抑制FGFR3,避免脫靶引起的副作用(如FGFR1相關的高磷血癥),目前處於臨床前開發階段。
副作用只是一方面,對於腫瘤患者而言,控制病情是關鍵,並且高磷血癥在臨床上可透過飲食和藥物控制。KIN003是一款新一代FGFR1-3抑制劑,由Kinnate Biopharma開發,是為了克服現有FGFR抑制劑(erdafitinib、pemigatinib、futibatinib)耐藥突變專門設計,對於gatekeeper和molecular brake突變都有活性。KIN003目前也處於臨床前開發階段。
總結
不論是泛FGFR抑制劑,還是精確亞型的FGFR高選擇性抑制劑,都有其臨床價值和市場前景。多靶點抑制劑、泛FGFR抑制劑已經在臨床研究中取得不俗的表現,仍然是疾病治療的重要選擇。不過,針對當前藥物的不良事件持續提高藥物安全性、克服耐藥以及不斷提高臨床獲益也是藥物研究持續進步的動力。期待,FGFR亞型選擇劑在臨床中的進一步突破,為患者提供更優的治療體驗。
- 上下滑動檢視參考文獻 -
參考資料
[1]Sleeman, M. et al.Identification of a new fibroblast growth factor receptor, FGFR5. Gene 271, 171–182(2001).
[2]Mehdi Touat, Ecaterina Ileana. Targeting FGFR Signaling in Cancer. Clin Cancer Res; 21(12) June 15, 2015
[3]PIASECKA D, BRAUN M, KITOWSKA K, et al. FGF/FGFRs-dependent signalling in regulation of steroid hormone receptors-implications for therapy of luminal breast cancer[J]. Journal ofExperimental & Clinical Cancer Research,2019, 38(230): 1-12. DOI: 10.1186/s13046-019-1236-6.
[4]Masaru Katoh. Fibroblast growth factor receptors as treatment targets inclinical oncology. Clinical Oncology. FEBRUARY 2019 | volume 16. https://doi.org/10.1038/s41571-018-0115-y
[5]Teresa Helsten , Sheryl Elkin. TheFGFR Landscape in Cancer: Analysis of 4,853 Tumors by Next-GenerationSequencing. Clin Cancer Res; 22(1) January 1, 2016
[6]Irina S. Babina, Nicholas C. Turner. Advances and challengesin targetingFGFR signalling in cancer.
[7]Graham RP, et al. Hum Pathol. 2014;45:1630‒1638.
[8]Farshidfar F, et al. Cell Rep. 2017;18(11):2780–2794.
[9] Ross JS et al. The Oncologist.2014;19:235–242.
[10]Daniel V.T. Catenacci, Drew Rasco.Phase I Escalation and Expansion Study of Bemarituzumab (FPA144) in PatientsWith Advanced Solid Tumors and FGFR2b-Selected Gastroesophageal Adenocarcinoma.J Clin Oncol 38:2418-2426.
實力靶點系列
HER2:突破向前,變革在後
B7-H3:免疫新秀,鋒芒漸露
CLDN18.2:群狼環伺,誰主沉浮?
Polθ:潛力迸發,巨頭入局
PI3K:諸侯爭霸,劍走奇峰
c-Met:奇峰陡起,再戰江湖