經典理論認為,癌症是由於人體內DNA突變的不斷累積造成的,只要啟用原癌基因、失活抑癌基因,癌症就發生了。
但是,同樣的突變在不同的情況下可能會致癌,也可能不致癌。例如,構成痣的細胞就存在BRAF基因突變,該突變在某些情況下會導致黑色素瘤,但是絕大多數的痣永遠也不會癌變。
那麼,這一現象背後的原因是什麼呢?
近日,由來自紀念斯隆-凱特琳癌症中心的Richard M. White博士和Lorenz Studer博士合作領銜的研究團隊,在著名期刊《科學》上發表重要研究成果[1]。
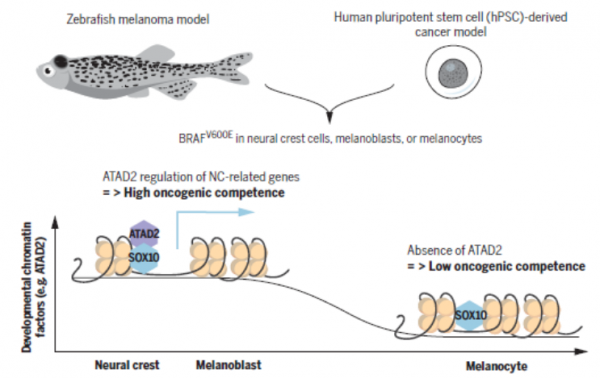
他們研究發現“致癌能力”是由致癌基因(如BRAFV600E)、譜系特異性轉錄因子(如SOX10)和發育調節的染色質因子(如ATAD2)共同介導的。
在面板細胞中,神經嵴譜系特異性機制的啟用和BRAFV600E等致癌突變是造成惡性腫瘤的基礎條件[2-7]。那麼,為什麼神經嵴的狀態特別容易受到BRAFV600E致癌突變的影響?
在發育過程中,神經嵴細胞產生黑色素母細胞,然後進一步分化為黑色素細胞。White博士利用斑馬魚模型,在抑癌基因p53突變的背景下,啟用BRAFV600E來引發腫瘤的產生。BRAFV600E由三種階段特異性啟動子驅動,分別是sox10啟動子(神經嵴細胞)、mitfa啟動子(黑色素母細胞)和tyrp1啟動子(黑色素細胞)。
研究發現由tyrp1啟動子控制的BRAFV600E並沒有激發黑色素細胞中腫瘤的產生,只是形成了小塊痣樣的細胞。這表明致癌基因表達可以使神經嵴細胞和黑色素母細胞有“致癌能力”,而黑色素細胞沒有。
透過對兩種不同的腫瘤進行組織學和RNA測序分析,發現這兩種腫瘤在組織學和轉錄水平都是不同的。神經嵴來源的腫瘤表達神經元基因,而黑色素母細胞來源的黑色素瘤表達與黑色素細胞譜系相近。
為了進一步做機制上的研究,White博士和Studer博士建立了人類多功能幹細胞(hPSC)模型:在hPSC中抑制RB1、P53和P16這三個抑癌基因(3xKO細胞),再透過多西環素(dox)誘導致癌的BRAFV600E表達來啟用腫瘤。3xKO工程化細胞隨後分化為神經嵴細胞、黑色素母細胞和成熟的黑色素細胞。

hPSCs 分化為神經嵴細胞、黑色素母細胞和黑色素細胞的示意圖
在NSG小鼠通皮下注射分化後的3xKO,發現了與斑馬魚相似的結果:3xKO dox神經嵴細胞和黑色素母細胞都容易形成腫瘤,而3xKO dox黑色素細胞基本上沒有。3xKO黑色素母細胞衍生腫瘤的所有黑色素瘤常見標誌物均呈陽性,而兩種RNA結合蛋白HuC和HuD呈陰性,並且在病理上被歸類為促纖維增生性黑色素瘤。
White和Studer對三種不同的細胞進行RNA測序,將表達譜和癌症基因組圖譜 (TCGA) 的資料對比,發現hPSC衍生的3xKO dox神經嵴細胞和3xKO dox黑色素細胞與人類黑色素瘤患者樣本具有顯著的相似性。這說明,研究人員透過hPSC衍生的腫瘤與人類患者有相關性。
透過對比WT和3xKO細胞在不同狀態下的RNA測序結果,White發現dox誘導的 BRAFV600E表達在神經嵴細胞和黑色素母細胞中都有顯著的轉錄變化。
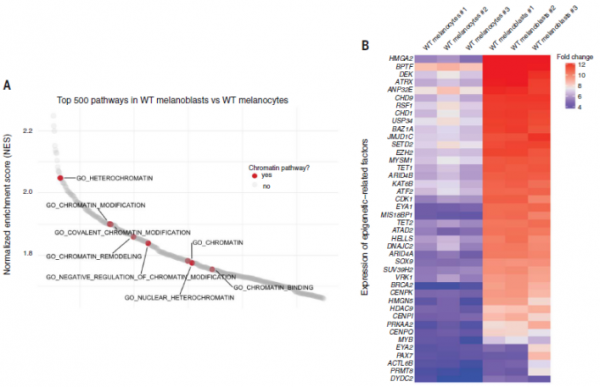
WT黑色素母細胞和WT黑色素細胞中的基因集通路分析(GSAA)顯示,與染色質修飾相關的多條通路在黑色素母細胞中富集,並且透過對兩種細胞進行染色質相關基因差異分析,發現了特定染色質修飾因子在黑色素母細胞中的富集。這表明黑色素母細胞表達表觀遺傳相關因子,能夠響應BRAFV600E改變其染色質狀態。
為了分析具體是哪個染色質因子最重要,White對比了黑色素細胞與黑色素母細胞的不同,並分析了在TCGA人類黑色素瘤佇列中哪些是表達量更高的,透過這些分析發現了3個相關因子:BPTF(溴基結構域PHD指轉錄因子)、ATAD2(ATP酶家族AAA結構域蛋白2)和 EZH2(zeste同源物2的組蛋白甲基轉移酶增強子)。
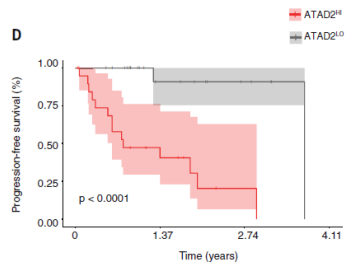
ATAD2是一種腺苷三磷酸酶(ATPase)[8],已知在染色質可及性中發揮作用,並且與黑色素瘤的存活率呈負相關[9];與其餘患者相比,表達較高的患者的存活率明顯更差。
White利用病毒在3xKO細胞中誘導ATAD2表達,發現沒有ATAD2的黑素細胞被黑色素深深著色,但表達ATAD2的3xKO黑色素細胞減少了色素沉著。
White接下來對3xKO dox黑色素母細胞、3xKO dox黑色素細胞和3xKO ATAD2 dox黑色素母細胞進行了高通量轉座酶可及染色質測序(ATAC-seq),發現黑色素母細胞中過表達ATAD2可以增加神經嵴相關位點染色質可及性。
透過進一步的機制研究,White利用Homer基序分析發現ATAD2富集基序是SOX10,表明ATAD2特異地與SOX10結合。對攜帶SOX10基序的基因座進行網路分析,發現了神經嵴遷移相關通路的富集。
有研究表明,ATAD2能夠與Myc構建蛋白複合物[10]。White假設ATAD2與SOX10可能以類似的方式發揮作用,透過直接與其結合並促進其靶基因的轉錄。
為了驗證這一想法,White分析了TCGA佇列中ATAD2高表達和ATAD2低表達患者的基因表達差異,發現ATAD2高表達患者的基因有明顯的Myc特徵且具有SOX基序富集。接下來White透過免疫共沉澱(co-IP)證實ATAD2與Myc形成複合物,並發現它也與SOX10形成複合物。
基於這些發現,White提出假設:ATAD2可能發揮雙重作用並促進Myc和SOX10轉錄因子靶基因的表達。White對3xKO ATAD2 dox黑色素母細胞中的ATAD2、SOX10和Myc進行了CUT&RUN分析,發現ATAD2與SOX10和Myc結合,並透過RNA-seq分析發現神經嵴相關基因(MEIS2、CDH2 和 CDH11)顯著富集。
為了研究ATAD2在體內環境下是否致癌,White在轉基因斑馬魚中特異性表達和敲減ATAD2,發現在神經嵴細胞和黑色素母細胞中高水平ATAD2表達促使BRAFV600E激發腫瘤。
以上研究表明致癌能力似乎取決於三個相互關聯的因素:DNA突變(例如BRAFV600E、p53-/-、CDKN2A-/-和PTEN-/-);細胞型別特異性轉錄因子(如SOX10和MITF);以及發育調控染色質修飾因子的固有水平。它們共同決定了癌症易感性。
這一研究重新整理了人們對於致癌機制的認知,可以研究靶向抑制ATAD2的藥物治療黑色素瘤,為黑色素瘤的治療提供了新的思路。
[1]Baggiolini A, Callahan SJ, Montal E, et al. Developmental chromatin programs determine oncogenic competence in melanoma. Science. 2021;373(6559):eabc1048. doi:10.1126/science.abc1048
[2]Kaufman CK, Mosimann C, Fan ZP, et al. A zebrafish melanoma model reveals emergence of neural crest identity during melanoma initiation. Science. 2016;351(6272):aad2197. doi:10.1126/science.aad2197
[3]White RM, Cech J, Ratanasirintrawoot S, et al. DHODH modulates transcriptional elongation in the neural crest and melanoma. Nature. 2011;471(7339):518-522. doi:10.1038/nature09882
[4] Varum S, Baggiolini A, Zurkirchen L, et al. Yin Yang 1 Orchestrates a Metabolic Program Required for Both Neural Crest Development and Melanoma Formation. Cell Stem Cell. 2019;24(4):637-653.e9. doi:10.1016/j.stem.2019.03.011
[5]Heppt MV, Wang JX, Hristova DM, et al. MSX1-Induced Neural Crest-Like Reprogramming Promotes Melanoma Progression. J Invest Dermatol. 2018;138(1):141-149. doi:10.1016/j.jid.2017.05.038
[6]Shakhova O, Zingg D, Schaefer SM, et al. Sox10 promotes the formation and maintenance of giant congenital naevi and melanoma. Nat Cell Biol. 2012;14(8):882-890. doi:10.1038/ncb2535
[7]Kunz M. Oncogenes in melanoma: an update. Eur J Cell Biol. 2014;93(1-2):1-10. doi:10.1016/j.ejcb.2013.12.002
[8]Boussouar F, Jamshidikia M, Morozumi Y, Rousseaux S, Khochbin S. Malignant genome reprogramming by ATAD2. Biochim Biophys Acta. 2013;1829(10):1010-1014. doi:10.1016/j.bbagrm.2013.06.003
[9]Morozumi Y, Boussouar F, Tan M, et al. Atad2 is a generalist facilitator of chromatin dynamics in embryonic stem cells. J Mol Cell Biol. 2016;8(4):349-362. doi:10.1093/jmcb/mjv060
[10]Ciró M, Prosperini E, Quarto M, et al. ATAD2 is a novel cofactor for MYC, overexpressed and amplified in aggressive tumors. Cancer Res. 2009;69(21):8491-8498. doi:10.1158/0008-5472.CAN-09-2131