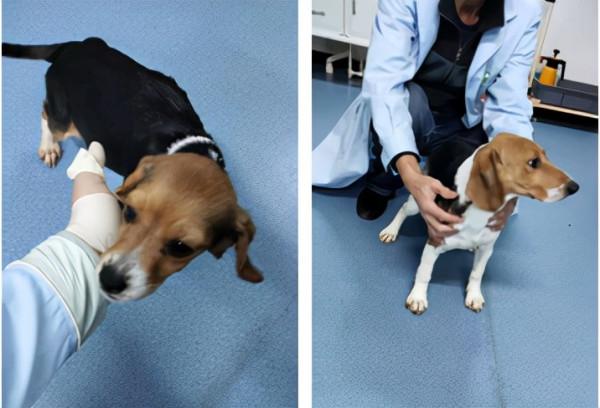
注射外源胰島素治療永久性新生兒糖尿病模型犬,左圖純合突變體,右圖嵌合突變體。賴良學團隊供圖
中國科學院廣州生物醫藥與健康研究院與北京希諾谷生物科技有限公司合作,利用單鹼基編輯器對葡萄糖激酶進行點突變,成功培育出世界首例人類永久性新生兒糖尿病犬模型。相關研究近日線上發表於《細胞發現》。
糖尿病是繼心血管疾病及腫瘤後的第三大疾病。目前,全世界糖尿病患者已超過4億,中國糖尿病患者已超過1億。其中,部分病例發生於新生兒時期,是由與分泌胰島素的β細胞功能相關的基因突變導致的遺傳性糖尿病。葡萄糖激酶(GCK)是葡萄糖代謝過程中的第一個限速酶,也是葡萄糖濃度感受器,在調節血液葡萄糖濃度中起著關鍵作用。
GCK基因突變在青少年糖尿病中所佔比例較大,且大多數為單核苷酸突變,純合或複合型的雜合突變會導致GCK蛋白完全失活,患者表現出永久性新生兒糖尿病,臨床症狀包括出生第一天開始高血糖、伴隨有生長緩慢、患者終身需要注射外源胰島素才能夠存活。
研究人員首次嘗試利用單鹼基編輯器對犬GCK基因進行點突變,使GCK基因上的CAG密碼子完成C到T的轉變,從而引入終止密碼子,提前終止GCK的翻譯,使GCK蛋白完全失去活性。其過程是首先從供體犬獲取受精卵,藉助顯微作業系統將體外轉錄的鹼基編輯器mRNA和sgRNA注射到受精卵中,然後將完成注射的受精卵移植入代孕犬的輸卵管內,使其在體內繼續發育成熟並分娩。
本實驗總共移植56枚受精卵,產下17只幼犬,共獲得4只GCK基因編輯犬,其中3只為純合突變,1只為嵌合體。GCK基因點突變小狗剛出生就表現出高血糖症狀,且生長緩慢,如果不注射外源胰島素,新生犬將在兩週內死亡,如果出生後第一天就開始注射胰島素,新生犬的血糖濃度趨於正常水平,可以長期存活,同時體重與沒有治療的幼犬相比也得到很大程度的恢復。
研究人員對RNA測序結果進行GO富集分析發現,注射外源胰島素的永久性新生兒糖尿病模型犬能促進脂類和脂肪酸等代謝,使犬的生理指標維持在一個相對正常的水平,從而能使其存活時間延長,這些特徵都與人類永久性新生兒糖尿病症狀一致。
該單鹼基基因編輯犬將為研究人類新生兒糖尿病的發生機制和開發新的治療方法,如藥物治療、幹細胞治療和基因治療等提供理想的動物模型。
“獲取能夠準確模擬人類該疾病的動物模型對疾病的發生機制研究和開發新的治療手段具有重大意義。犬是一種雜食性動物,在代謝、生理、生活習性和解剖特徵等方面與人類非常接近,因此是研究人類糖尿病的理想動物模型。”賴良學說。
相關研究工作得到國家重點研發計劃、中國科學院戰略先導專案、廣東省和廣州市科技計劃等專案資助。
相關論文資訊:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8505425/

















