“新冠,任何時候都要剿!不剿不行,你們想想,不會做飯的你獨自在外租著房,快過年了打算明天就回家蹭吃蹭喝,突然第二天早上發現小區被封了,全市被封了……所以,沒有新冠的日子才是好日子!”
2020年初,新冠開始席捲全球。而就在今年剛開啟的四天,作為一隻生活在石家莊的奇點糕,也終於身歷其境。
不管是摻雜著怎樣的心情,相信現在很多人都因為疫情有了各種難以忘懷的經歷。一週之前,奇點糕的兩個同事就被告知封小區,只能在家辦公,有同事為此感到可(xian)惜(mu)。
我們難以忘記疫情中的經歷,而我們的免疫系統也會對新冠病毒的入侵留下深刻記憶。
近日,由哥倫比亞大學的Donna Farber教授和La Jolla免疫研究所的Shane Crotty教授合作領銜,找到了新冠感染具有長期免疫記憶的直接證據。他們發現,在新冠患者的肺部以及肺周圍的淋巴結中不僅存在SARS-CoV-2特異性記憶T細胞、記憶B細胞,還存在SARS-CoV-2特異性生髮中心[1]。
這對於疫苗接種或最佳化免疫的設計具有重要的指導意義。文章發表在《科學》旗下子刊Science Immunology上。
雖然已有很多研究接連發現,新冠患者確實在康復數月甚至一年後仍有特異性免疫。但是,這些研究中的樣本無一例外全都是外周血[2-9],目前還沒有相關研究從器官組織中尋找記憶細胞。
而實際上,適應性免疫反應在器官組織中也執行著保護功能。
那些只存在於器官組織中、不存在於迴圈系統和血液中的記憶T細胞稱為組織駐留記憶T細胞(Trm)。組織駐留記憶T細胞對於機體免疫保護、抵禦病毒感染非常重要,能夠及時識別抗原,直接原地出警,並呼叫免疫系統增援[10-12]。
於是,研究者們便期望能夠從新冠患者器官組織中找到這些記憶細胞。
幸運的是,研究者們成功尋獲到4名感染新冠後康復的患者(10-74歲)的器官樣本。這些患者的死因與新冠無關,並在去世後進行了器官捐獻,SARS-CoV-2 PCR為陰性。另一方面,研究者們也選擇了一些未感染新冠的器官捐獻者作為對照。
一系列研究後發現,即使感染新冠6個月後,患者的骨髓、脾、肺以及多處淋巴結中依然存在SARS-CoV-2特異性記憶T細胞和記憶B細胞,而肺部和肺部相關淋巴組織是這些記憶細胞分佈的最主要部位。
其中,在新冠康復患者的這些器官組織以及血液中,CD4+記憶T細胞普遍比CD8+記憶T細胞的丰度更高一些,但CD8+記憶T細胞的個體間水平差異更大。血液以及不同組織部位的記憶T細胞亞群也有所不同。
在肺部和肺部相關淋巴組織中,佔比最多的SARS-CoV-2特異性記憶B細胞是IgG+型。在其它組織以及血液中,也都存在IgG+、IgM+、IgA+型記憶B細胞。
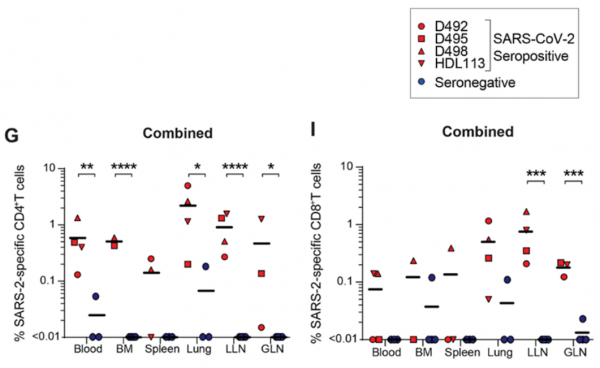
所有表位的記憶CD4+T細胞和記憶CD8+T細胞在血液和不同組織中的丰度
不僅如此,研究者們還找到了更直接的證據來證明,新冠病毒感染給免疫系統留下了深刻記憶。
他們在新冠患者的肺和肺相關淋巴組織中發現了SARS-CoV-2特異性生髮中心,以及濾泡輔助性T細胞(TFH)。
當病毒感染或抗原免疫後,次級淋巴器官(如脾臟和淋巴結)中便會形成一個微結構——生髮中心。B細胞能夠在這裡實現克隆增殖,並在TFH的協助下,產生更加長壽、具有更高親和力的記憶B細胞和漿細胞[13]。
也就是說,在被新冠病毒感染後,肺部和肺部相關淋巴系統專門為新冠病毒成立了一個B細胞專案小組,建立起長久免疫記憶,以更及時、高效地對抗再次感染。
總的來看,研究者們的這些發現足以證明,新冠患者在受病毒感染後,不僅是血液中,骨髓、脾、肺以及多處淋巴結這些區域性組織也都能產生免疫記憶。而“記憶最深刻”的組織,便是肺部和肺部相關淋巴系統。
值得注意的是,在這四名器官捐獻者中,有兩名新冠康復患者的年齡超過70歲。
我們通常認為,免疫系統在老年就進入待機狀態,基本靠已有的記憶細胞來保護自己。但這項研究中發現,這兩名老人在感染新冠病毒後,肺部和肺部相關淋巴系統中也出現了生髮中心。
研究者們說:“70多歲的老人依然可以產生顯著而持久的免疫記憶,這說明當我們老去時,一些被認為是和年齡相關的免疫系統其實還在運作。”

另外,研究者們目前也對接種過疫苗的器官捐贈者展開研究,以確定疫苗引起的免疫記憶與自然感染引起的免疫記憶是否相似。
他們表示,如果未來能夠更有針對性地設計疫苗,比如噴鼻型疫苗,幫助肺部和肺部相關組織在真正的新冠病毒入侵前就建立起特異性生髮中心,也許會提高疫苗的效益。
最後,奇點糕還是想再感謝一波疫情來臨時,堅守崗位的醫護人員、志願者!大家自己還是要做好個人防護,等這個冬天的疫情度過,冬奧會來到之前,張家口雪場約起來~
參考文獻:
[1]Poon MML, Rybkina K, et al. SARS-CoV-2 infection generates tissue-localized immunological memory in humans. Sci Immunol. 2021 Oct 7:eabl9105.
[2]J. M. Dan, J. Mateus, et al. Immunological memory to SARS-CoV-2 assessed for up to 8 months after infection. Science 371, ••• (2021).
[3]A. Grifoni, D. Weiskopf, et al. Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Individuals. Cell 181, 1489–1501.e15 (2020).
[4]C. Gaebler, Z. Wang, et al. Evolution of antibody immunity to SARS-CoV-2. Nature 591, 639–644 (2021).
[5]Z. Wang, F. Muecksch, et al. Naturally enhanced neutralizing breadth against SARS-CoV-2 one year after infection. Nature 595, 426–431 (2021).
[6]L. B. Rodda, J. Netland,et al. Functional SARSCoV-2-Specific Immune Memory Persists after Mild COVID-19. Cell 184, 169–183.e17 (2021).
[7]T. Bilich, A. Nelde, et al. T cell and antibody kinetics delineate SARSCoV-2 peptides mediating long-term immune responses in COVID-19 convalescent individuals. Sci. Transl. Med. 13, eabf7517 (2021).
[8]K. W. Cohen, S. L. Linderman, et al. Longitudinal analysis shows durable and broad immune memory after SARS-CoV-2 infection with persisting antibody responses and memory B and
T cells. Cell Rep Med 2, 100354 (2021).
[9]J. Zuo, A. C. Dowell, et al. Robust SARS-CoV-2-specific T cell immunity is maintained at 6 months following primary infection. Nat. Immunol. 22, 620–626(2021).
[10]P. A. Szabo, H. M. Levitin, et al. Single-cell transcriptomics of human T cells reveals tissue and activation signatures in health and disease. Nat. Commun. 10, 4706 (2019).
[11] D. Masopust, A. G. Soerens, Tissue-Resident T Cells and Other Resident Leukocytes. Annu. Rev. Immunol. 37, 521–546 (2019).
[12] D. L. Farber, Tissues, not blood, are where immune cells function. Nature 593, 506–509 (2021).
[13]G. D. Victora, M. C.Nussenzweig, Germinal centers. Annu. Rev. Immunol. 30, 429–457 (2012).