11月1日,Incyte宣佈,美國FDA已受理其在研高活性、高選擇性的新一代口服磷脂醯肌醇3-激酶δ (PI3Kδ)抑制劑parsaclisib的新藥上市申請(NDA)。用於治療復發或難治性濾泡性淋巴瘤(FL)、邊緣區淋巴瘤(MZL)和套細胞淋巴瘤(MCL)。
FDA還授予parsaclisib優先審評資格,用於既往接受過至少一種基於抗CD20治療方案的復發或難治性MZL成人患者,以及既往接受過至少一種治療方案的MCL成人患者,預定的PDUFA日期為2022年4月30日。parsaclisib用於已接受至少兩種既往全身治療的複發性或難治性FL成人患者NDA預定的PDUFA日期為2022年8月30日。
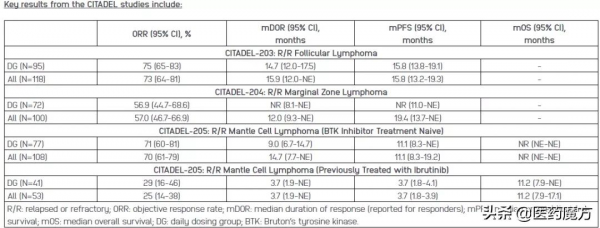
此項NDA申請是基於parsaclisib治療復發或難治性濾泡性(CITADEL-203)、邊緣區(CITADEL-204)和套細胞性(CITADEL-205)淋巴瘤患者的多項II期研究積極結果(見下表)。parsaclisib在所有研究中均具有良好的耐受性和可管理的安全性。
Parsaclisib用於MCL (CITADEL-310)、復發或難治性FL和MZL (CITADEL-302)的III期驗證研究正在準備中。
2018年12月,信達生物與Incyte就parsaclisib以及pemigatinib(FGFR1/2/3抑制劑)、itacitinib(JAK1抑制劑)達成戰略合作,獲得了這3款藥物在中國大陸及港澳臺的開發和商業化權利。在國內,parsaclisib已獲得CDE突破性療法認定,用於治療復發或難治性FL。
非霍奇金淋巴瘤(NHL)是一種始於淋巴細胞的癌症。濾泡性淋巴瘤(FL)、邊緣區淋巴瘤(MZL)和套細胞淋巴瘤(MCL)是B細胞性NHLs的幾種型別。FL和MZL是屬於惰性、生長緩慢的淋巴瘤型別,而MCL屬於侵襲性、快速進展的型別。對於復發或初始治療難治的患者,臨床需求仍未得到滿足。
“非霍奇金淋巴瘤是美國最常見的癌症之一,FDA接受此項NDA對Incyte和對初始治療無應答或接受初始治療後疾病進展的NHL患者來說是一個重要的里程碑,”Incyte腫瘤靶向療法部副總裁Peter Langmuir醫學博士說。“我們期待與FDA合作,將這種創新療法帶給可能受益的患者。”