2021年11月1日,《OncLive》醫學線上期刊報告了拉羅替尼(Larotrectinib)在TRK融合陽性肺癌患者中的有效性和安全性,該資料已在2021年世界肺癌會議年會上提交。
TRK,即原肌球蛋白受體激酶(tropomyosin receptor kinase),是調節細胞通訊和腫瘤生長的重要訊號通路,而NTRK是編碼TRK的基因。在罕見情況下,NTRK基因會與其它基因融合,導致TRK訊號通路不受控制,因而促進腫瘤的生長。NTRK基因融合在多種成人和兒童實體腫瘤中具有結構性活性,並作為致癌驅動因子。在非小細胞肺癌的發生率估計為0.1~1.0%。
此前,2018年11月26日,美FDA已批准了拉羅替尼用於NTRK基因(包括NTRK1、NTRK2、NTRK3)融合的實體腫瘤成人及兒童患者。這是全球首個獲批上市的與腫瘤型別無關的“廣譜”抗癌藥。2019年6月,拉羅替尼在中國香港上市。
拉羅替尼是一種高效、高度選擇性和具有中樞神經系統(CNS)活性的歐洲藥品管理局(EMA)和FDA批准的TRK抑制劑。
商品名:VITRAKVI
通用名:Larotrectinib(拉羅替尼)
靶點:NTRK
美國首次獲批:2018年11月
中國香港上市:2019年6月
獲批適應症:NTRK基因融合的實體瘤
推薦劑量:
對於體表面積大於1㎡的成人或兒童患者,推薦劑量為100mg每次,每天兩次,與食物或不與食物同服皆可;
對於體表面積小於1㎡的兒童患者,推薦劑量為100mg/㎡(按體表面積計算)每次,每天兩次,與食物或不與食物同服皆可。
臨床資料
該研究資料是從接受拉羅替尼治療的I期(n=1)和II期(n=19)臨床試驗(分別為NCT02122913和NCT02576431)的具有NTRK基因融合的肺癌患者中收集的。納入的患者接受100 mg拉羅替尼治療,每天2次,連續 28天給藥。
研究的主要終點是由獨立評審委員會(IRC)和研究者根據 RECIST v1.1標準評估的最佳客觀緩解率(ORR)。次要終點包括反應持續時間(DoR),無進展生存期(PFS),總生存期(OS)和安全性。
入組患者的人群特徵包括:中位年齡為48.6歲;男性和女性患者各佔研究人群的50%;45%的患者為白人,40%的患者為亞洲人;ECOG評分主要為0(40%)和1(50%);95%的患者組織學為腺癌;10例患者有基線性中樞神經系統轉移,其中2例患者之前接受過放療;既往接受的治療包括:手術(50%)、放療(45%)、全身性治療(95%)。
研究結果顯示:在15例可評估患者中,由IRC評估的ORR為87%,2例完全緩解(CRs), 11例部分緩解(PRs), 2例病情穩定(SD);研究者評估的ORR為73%,1例CR,10例PR,3例SD,1例PD。此外,所有患者均報告腫瘤縮小。
在基線時有中樞神經系統轉移的可評估患者(n=8)中,由IRC評估的ORR為88%,無CR,7例PR,1例SD;研究者評估的ORR為63%,無CR,5例PR,2例SD,1例PD。
圖注:拉羅替尼(larotrectinib)治療NTRK融合陽性肺癌患者的臨床療效
該研究的治療持續時間為0.03+到51.5+個月。在總體患者中,中位緩解持續時間(DOR)為15.6個月,12個月的DOR率為64%;中位無進展生存期(PFS)為22.1個月,12個月的PFS率為62%;中位總生存期(OS)為12.6個月,12個月的OS率為86%。
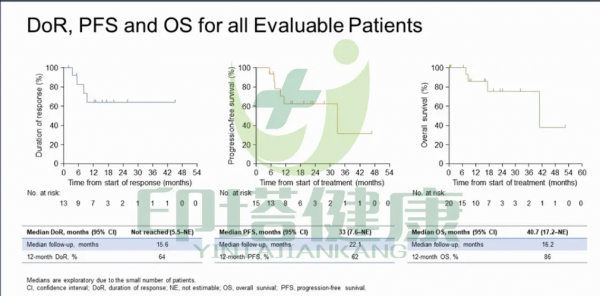
圖注:拉羅替尼(larotrectinib)治療NTRK融合陽性肺癌患者的DOR、PFS、OS
在基線時有中樞神經系統轉移患者中,中位DOR為17.4個月,12個月的DOR率為21%;中位PFS為19.3個月,12個月的PFS率為18%;中位OS為10個月,12個月的OS率為71%。
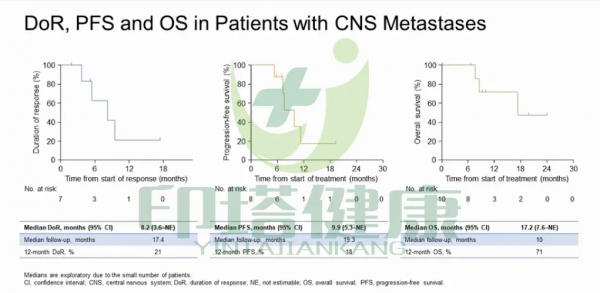
圖注:拉羅替尼(larotrectinib)治療NTRK融合陽性肺癌腦轉移患者的DOR、PFS、OS
安全性
在安全性方面,拉羅替尼耐受性良好,治療中出現的不良反應主要是1~2級;發生3級不良反應包括:超敏反應、肌痛、體重增加;沒有出現4級不良反應;只有1例發生了5級不良反應:心臟驟停,但與拉羅替尼無關。
2例患者因不良反應減少劑量,2級AST和2級ALT升高(1例)、2級中性粒細胞減少(1例)。沒有患者因不良反應停止治療。
圖注:拉羅替尼(larotrectinib)治療NTRK融合陽性肺癌患者的安全性
結論
拉羅替尼被證明在具有 NTRK 基因融合的晚期肺癌患者中具有高度活性,包括具有CNS轉移的患者。該藥物具有良好的安全性。這些結果支援將NTRK基因融合納入肺癌患者的常規分子檢測中。
【重要提示】本公號【全球好藥資訊】所有文章資訊僅供參考,具體治療謹遵醫囑!
















