多發性骨髓瘤(MM)是一種異質性疾病,2021年美國預計有34920例新診斷MM病例。隨著蛋白酶體抑制劑(PI)、免疫調節劑(IMiD)和單克隆抗體的應用,標危MM患者的總生存期(OS)已超過10年。但仍有25%-45%的高危MM患者預後較差,中位OS為18-24個月。MM患者在自體造血幹細胞移植(ASCT)後用或不用來那度胺(Len)維持治療均會面臨復發。既往有研究顯示,ASCT後的T細胞克隆擴增與患者臨床結局改善相關。因此,研究者們假設將檢查點抑制劑用於MM患者ASCT後鞏固治療,能重新激發T細胞炎症表型,以靶向殘留MM。另外,Len可增強T細胞和NK細胞效應以達到抗MM作用,降低MM細胞上的PD-L1表達。基於此,研究者們開展了一項開放標籤、II期單臂臨床試驗,評估PD-1抑制劑帕博利珠單抗聯合來那度胺和地塞米松(Pembro-Rd)在MM患者ASCT後鞏固治療中的療效及安全性。
研究方法
患者在ASCT後第+60天至+180天之間入組,並接受Pembro-Rd治療,共4個週期。完成第4週期後,對每例受試者隨訪30天。收集治療結束後90天內的嚴重不良事件。因疾病進展以外的原因中止治療的受試者繼續治療後隨訪。納入該項研究的患者均為高危MM(HRMM)成人患者,高危定義為以下任何一項:國際分期系統(ISS)為III期;透過細胞遺傳學確定的del(13q);FISH伴1q擴增、1p缺失、p53缺失、t(4;14)、t(14;16)、t(14;20)、低二倍體;高風險基因表達譜評分。對於療效達到≥非常好的部分緩解(VGPR)的患者,在第4週期後30天進行微小殘留病(MRD)評估。
研究結果
該研究計劃入組58例患者。然而,由於Pembro組中免疫相關毒性和死亡的發生率更高,FDA於2017年7月3日停止了評價PD-1或PD-L1抑制劑與IMiD聯合用藥的所有研究。在FDA暫停時,已經入組了12例患者,並允許進行隨訪。
1基線特徵
入組的12例患者中,5例(41.7%)ISS為III期,6例(50%)FISH檢測顯示p53缺失,3例(25%)顯示1q21擴增,FISH檢測顯示同時存在1q21擴增和13q缺失的超高危患者有2例(17%)。所有患者均接受三聯或四聯誘導治療,其中5例(42%)接受硼替佐米-Len-Dex(VRd)誘導治療;4例(33%)接受卡非佐米-Len-Dex(KRd)誘導治療;2例(24.9%)接受硼替佐米-環磷醯胺-Dex(VCd)誘導治療;1例患者接受硼替佐米-環磷醯胺-Len-Dex(VCRd)誘導治療。
2療效
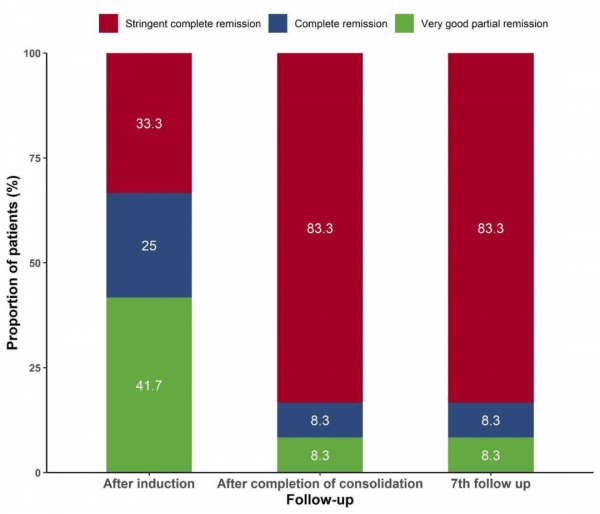
中位隨訪時間為50.7個月(範圍:6-55.5個月),所有患者從ASCT之日起的中位無進展生存期(PFS)為27.7個月(95% CI:22.6-未達到)。1年和2年PFS率分別為90.9%和63.6%。患者在最佳緩解時的總緩解率(ORR)為100%。患者嚴格意義上完全緩解(sCR)率在誘導治療結束時為33%,在鞏固結束時為83.3%,在預先設定的第7個隨訪點(治療完成後中位時間為19個月)為83.3%(圖1)。在2年隨訪期間,≥CR的患者有11/12例(91.7%),達到sCR的患者有10/12例(83.3%)。在完成治療的11例患者中,有8例評估了MRD狀態,其中7例(87.5%)經多引數流式細胞術檢測達到了MRD陰性(臨界值為10-5)。
3安全性
所有患者均發生1次或多次歸因於Pembro、Len或Dex的不良事件(AE)。在報告的97例AE中,6.2%為3級,93.8%為1或2級。最常見的非血液學AE為咳嗽、腹瀉和便秘,均為1或2級;而最常見的血液學AE為中性粒細胞減少症。1-3級免疫介導的AE包括腹瀉(4例)、發熱(1例)、斑丘疹(1例)和呼吸困難(2例),均為1或2級,有1例嚴重AE,因流感嗜血桿菌肺炎需要住院,但與Pembro無關。
4效應T細胞變化
與第一個治療週期開始(C1D1)相比,CD3區室中的中位效應記憶CD4+T細胞百分比在C4D1前穩定下降(P = 0.037)。CD3細胞群中的效應記憶CD8區室在第2個週期(C2D1)時表現出小幅降低(P = 0.032),並在第3個週期時恢復至未顯著增加的水平(P = 0.199)。在第2個週期(C2D1)和第3個週期(C3D1),中位記憶Tregs細胞降低(分別為P = 1.0,P = 0.199)。
研究結論
該研究結果表明,PD-1抑制劑聯合Len作為ASCT後鞏固治療,在12例HRMM患者中具有良好耐受性和療效,中位PFS為2.3年,超過了歷史研究中不使用Len維持治療的HRMM患者的PFS。免疫介導的AE均為1或2級,而觀察到的1例嚴重AE與Pembro無關。
參考文獻:Noa Biran , Elli Gourna Paleoudis , Rena Feinman , Pembrolizumab, lenalidomide and dexamethasone post autologous transplant in patients with high-risk multiple myeloma. Am J Hematol. 2021 Nov 1;96(11):E430-E433.