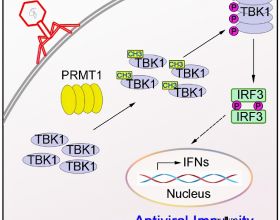
腦膠質瘤是最致命的惡性腫瘤之一,平均生存期只有15個月,臨床上缺乏有效的治療手段。近期,廈門大學劉文教授團隊在Molecular Therapy期刊上發表題為 BRD4 inhibition boosts the therapeutic effects of epidermal growth factor receptor-targeted chimeric antigen receptor T cells in glioblastoma 的研究論文,提出將表觀遺傳調控與免疫治療相結合的新型腦膠質瘤治療策略。
研究團隊首先揭示了EGFR是腦膠質瘤中一個潛在的治療靶點,構建了一種靶向EGFR的新型CAR-T細胞(EGFR CAR-T),並發現其可以在體外有效抑制腦膠質瘤細胞以及小鼠體內有效抑制細胞和病人來源腦膠質移植瘤的生長。然而,和其它許多免疫腫瘤治療方法一樣,隨著治療時間的延長,部分小鼠對EGFR CAR-T細胞治療產生耐受,限制了其在臨床上的應用潛力。
研究團隊進一步致力於尋找克服耐受的方案。透過對EGFR CAR-T細胞孵育的腦膠質瘤細胞進行了RNA-seq分析,發現EGFR CAR-T會透過干擾素γ(IFNγ)誘導一系列和免疫抑制相關的基因的表達。進一步ChIP-seq分析揭示這些免疫抑制基因附近的增強子富集啟用相關標誌物。於是,研究團隊提出干預相關增強子的啟用將有望干預免疫抑制基因的啟用,從而克服免疫耐受。
透過對一些靶向參與增強子啟用的表觀遺傳調控因子的抑制劑的篩選發現BRD4的抑制劑JQ1能有效抑制相關增強子及其鄰近免疫抑制基因的啟用,而且發現BRD4是啟用這些免疫抑制基因所必需的。相應地, JQ1與EGFR CAR-T細胞聯合治療的方案在多種腦膠質瘤原位移植瘤模型中(包括人U87細胞來源的原位移植瘤模型,腦膠質瘤病人來源的原位移植瘤模型等)能高效地抑制腫瘤的生長和轉移,延長小鼠的生存期。該研究證實透過靶向表觀遺傳調控因子進行轉錄調控可以提高包括CAR-T在內的免疫治療的療效,為臨床治療腦膠質瘤提供了潛在的治療途徑。
綜上,研究團隊構建了一種新型CAR-T細胞,證實了表觀遺傳因子抑制劑聯合腫瘤免疫治療能更有效抑制癌症的發生發展和緩解腫瘤免疫治療引起的耐受,為癌症治療提供了一種新思路和潛在的新方式。
圖文摘要
廈門大學藥學院劉文教授為文章的通訊作者,課題組助理教授夏琳、博士生鄭早早和丁建成、碩士生陳宇潔和公共衛生學院博士生劉珺懿為共同第一作者。該研究工作也得到了公共衛生學院的夏寧邵教授、黃承浩助理教授和藥學院曾子晏教授的支援和建議。