前言
隨著第一個雙特異性抗體卡妥索抗體(Catumaxomab)在歐盟獲得批准,越來越多的雙特異性抗體藥物進入研發管線,國內企業也紛紛佈局。近日,國內雙特異性抗體專案好訊息不斷,康方生物的PD-1×CTLA-4雙特異性抗體進度全球領先,有望衝擊首個獲批上市PD-1的雙特異性抗體,康寧傑瑞的PD-L1×CTLA-4雙特異性抗體不甘示弱,佔領PD-L1雙抗高位,成為全球領先。基於目前雙特異性抗體的發展勢頭強勁,接下來,Dr.G就帶領大家一起了解下雙特異性抗體的相關知識。
1. 雙特異性抗體的概念
單克隆抗體在20世紀90年代首次進入市場,截止目前,由美國FDA批准上市的抗體高達百餘種。用於靶向治療的單克隆抗體在人類許多重大疾病的治療上發揮了巨大的作用,如癌症、炎症性疾病和病毒感染等。但是,疾病的發生通常病因非常複雜,涉及到許多因素及訊號通路之間的相互作用,所以單一的靶向治療是存在侷限性的,而且越來越多的臨床資料表明,單克隆抗體的治療並未達到預期的治療效果。因此,為了提高抗體治療臨床療效,針對兩種抗原的雙特異性抗體(bispecificantibody, BsAbs)成為治療性抗體的發展方向。
雙特異性抗體是指可以與同一抗原的兩個不同抗原表位或者兩個不同抗原相結合的一種分子。其作用機制更加靈活,可以發揮兩種單抗聯用的協同作用,從而實現免疫治療的“一箭雙鵰”,甚至可以達到1+1>2的效果。雙特異性抗體在自然狀態下並不存在,需要透過基因工程或者細胞融合技術而實現的。

圖1:雙特異性抗體的基本結構(來源:amgenscience.com)
2. 雙特異性抗體的發展歷程
1960年,Nisonoff等人將兩種不同的抗原結合片段透過再氧化連線到一起,證明了該產物可以募集兩種不同型別的細胞,首次提出了雙特異性抗體的概念。
1983年,Milstein等人第一次利用融合的兩種雜交瘤細胞生產出不對稱結構的雙特異性抗體,該方法避免了化學合成法在處理抗體進行解鏈時引起蛋白變性導致的抗體失活。生產的不對稱結構與天然抗體結構類似,具有最低的免疫原性,在臨床治療方面具有顯著的優勢。但在融合雜交瘤細胞的重鏈和輕鏈的隨機配對中,產生了大量的無用抗體,使得雙特異性抗體的產率極低,這一現象被稱為鏈交聯問題。
1985年,Perez等人第一次提出了可以特異性靶向T細胞表面受體T3和靶細胞表面抗原的雙特異性抗體,研究表明,該抗體可以特異性連線效應細胞,使其殺傷第二抗原結合位點結合的靶細胞,增強抗體依賴的細胞毒作用。該研究使用的靶細胞包括雞紅細胞和異種腫瘤細胞,揭示了效應細胞的重定向可以用於腫瘤或其他表達特異性表面抗原的病原體的體內治療,基於雙特異性抗體的免疫治療奠定了基礎。
1993年,抗體二聚體Diabodies橫空出世,因其不含Fc段的雙特異性抗體、抗體分子小、組織穿透能力強、易於抵達病灶位置等特點,在免疫治療中有著重要的作用。
1995年,Lindhofer等人發現將大鼠和小鼠雜交瘤進行融合,可以增加輕鏈與重鏈配對的正確率,他們這一發現解決了鏈交聯問題,同時使得雙特異性抗體的產率顯著增加,提供了其大規模生產的可能性。
2009年,世界上第一個雙特異性抗體藥物卡妥索抗體(Catumaxomab)在歐盟獲得批准,用於治療EpCAM陽性的惡性腹水患者。由於其副作用較大以及其它商業因素,最終於2017年6月官宣退市。
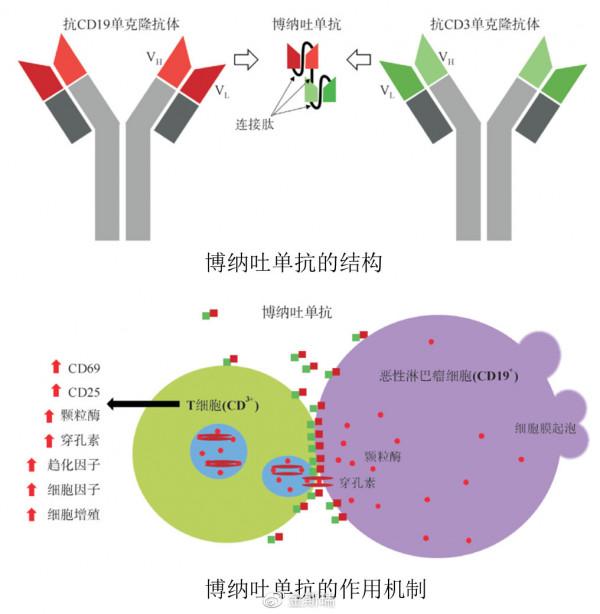
2014年,博納吐抗體(Blinatumomab)在美國獲得批准,它一端可以與B細胞表面的CD19結合,另一端可以與T細胞表面的CD3結合。它是首個美國食品藥品監督管理(FDA)批准的CD19雙特異性抗體,用於前體B細胞急性淋巴細胞白血病的治療,並於2015年獲得歐盟批准。上市後,博納吐單抗一路高歌猛進,成為市場上價格最高的藥物之一。
2017年,艾美賽珠單抗(Hemlibra)在美國獲得批准,成為血友病領域的首個雙特異性抗體藥物,用於存在Ⅷ因子抑制物的血友病的常規預防,並於2018年在歐盟獲得批准。艾美賽珠單抗的獲批預示著血友病的治療不再侷限於傳統的凝血因子替代療法,適應症大幅拓寬了艾美賽珠的使用範圍,向免疫療法和基因療法邁進。
2021年5月,楊森生物研發的Amivantamab獲得美國FDA批准上市,它是一種靶向c-MET/HGFR、EGFR的雙特異性抗體,用於治療EGFR突變的非小細胞肺癌。
3. 雙特異性抗體的作用機制
雙特異性抗體主要是透過以下3中作用機制發揮作用:(1)雙靶點訊號阻斷;(2)介導免疫細胞殺傷;(3)促進蛋白形成功能性複合體。
3.1 雙靶點訊號阻斷
腫瘤等疾病的發生、發展往往涉及多條訊號通路。單一訊號通路阻斷往往不能完全抑制疾病程序,同時還容易引起其他補償通路啟用。雙特異性抗體可以特異性阻斷多條訊號通路,達到更好的抑制疾病效應。目前多個雙靶點阻斷的雙特異性抗體處於早期臨床研究階段,涵蓋了腫瘤、自身免疫性疾病和抗感染等多個治療領域。如HER家族的EGFR,HER2,HER3等多個成員是腫瘤治療的重要靶標,靶向EGFR的西妥昔單抗、靶向HER2的曲妥珠單抗以及帕妥珠單抗等均已獲批上市。然而,研究顯示,除EGFR,HER2,HER3等成員的同源二聚外,不同成員之間的異源二聚介導的啟用訊號在腫瘤發生發展過程中也發揮重要作用,同時阻斷多個訊號分子,可以有效提高抑瘤效應、減少耐藥。因此,EGFRX HER2,HER2×HER3等多個靶向不同受體的雙特異性抗體處於不同階段開發程序中。值得注意的是,除了不同訊號分子外,同一個訊號分子的不同功能表位也能介導不同的胞內訊號,同時阻斷2個不同的功能表位也能產生良好的協同效應。
除腫瘤領域外,自身免疫性疾病、過敏性疾病等免疫相關疾病也是該類機制的雙特異性抗體研發重點。如靶向TNF-αX IL17,IL-4 X IL13,IL17X IL13等不同靶點的雙特異性抗體在自身免疫病、哮喘、瀰漫性面板系統性硬化症等多種疾病臨床治療中取得進展。
3.2 介導免疫細胞殺傷
雙特異性抗體的一個重要作用機制是介導免疫細胞殺傷,如NK細胞、T細胞及巨噬細胞等。近年來,隨著對癌細胞免疫逃逸機制認識的深入,啟用免疫細胞,特別是啟用T細胞的抗體藥物研究備受重視。啟用T細胞往往需要雙重訊號:第一訊號來自抗原提呈細上MHC-抗原複合物與T細胞受體TCR-CD3的結合;第二訊號為T細胞與抗原提呈細胞表達的共刺激分子相互作用後產生的非抗原特異性共刺激訊號。由於多數癌細胞表面的MHC的表達下調甚至缺失,從而逃逸免疫殺傷。抗CD3 的雙功能抗體則能夠分別結合 T細胞表面CD3 分子和癌細胞表面抗原,從而拉近細胞毒性T 細胞與癌細胞的距離,引導T細胞直接殺傷癌細胞,而不再依賴於 T 細胞的雙重啟用訊號。抗CD3 雙功能抗體獨特的T細胞啟用方式被認為是其作用機制上的重大優勢。目前已上市的兩個雙特異性抗體卡妥索抗體(Catumaxomab)和博納吐抗體(Blinatumomab)均透過介導T細胞殺傷腫瘤細胞,此外靶向CD20,CD19,CEA,gpA33,CD123,HER2及GP100 等靶點並介導T細胞殺傷的雙特異性抗體已進入臨床研究。

圖4:T細胞活化作用機制(來源:immunology.org)
3.3 促進蛋白形成功能性複合體
甲型血友病是凝血因子Ⅷ編碼基因突變、基因缺失、基因插入等導致該凝血因子功能缺陷引起的一種凝血功能障礙性遺傳病。生理條件下,凝血因子VIII與啟用的凝血因子IX形成複合物,在鈣離子的存在下,啟用的凝血因子IX進而啟用下游的凝血因子X,從而啟動凝血級聯反應。目前常用血液提取或重組的凝血因子Ⅷ作為補充劑進行替代治療,但是臨床上約有30%左右患者會針對外源凝血因子Ⅷ產生特異性抗體,導致無法繼續使用此類藥物。
2017年,靶向向凝血因子X和IXa的雙特異性抗體艾美賽珠單抗(Hemlibra)在美國獲得批准,其作用機制就是同時連線凝血因子X和IXa,從而效仿凝血因子VIII的生理功能,促進凝血酶的產生。因此,該抗體的上市也豐富了雙特異性抗體獨特的生物學機制。
4. 全球雙抗專案研發概況
針對雙特異性抗體的特殊的作用機制,研究人員可以設計出獨特的雙特異性抗體分子,從而實現單克隆抗體無法完成的生物學功能。目前,雙特異性抗體已經成為了藥物研究領域中的新熱點。Cortellis藥物發現數據庫共收錄雙特異性抗體802個,根據視覺化分析結果可以發現,目前已有145種雙特異性抗體處於臨床研發階段,雙特異性抗體的作用機制非常多樣化,靶點主要集中在CD3、PD1/PDL1、EGFR、HER2。從企業看,目前全球佈局雙抗專案已進入臨床試驗階段的公司包括強生、羅氏、再生元、中外製藥等公司。國內企業雙特異性抗體佈局的公司包括三生製藥、信達生物、友芝友、康寧傑瑞、岸邁生物等。
結語
雙抗是對單克隆抗體進行基因工程改造的一個重要突破,可以同時靶向兩個表位。在某些治療領域,雙抗的出現已經彰顯出單克隆抗體乃至單克隆抗體組合療法無法媲美的優勢。現在國際上比較主流的雙抗平臺有羅氏CrossMab平臺、GenMab的Duobody平臺、艾伯維DVD-Ig平臺等。與此同時,國內多家企業也已經開發出比較成熟的雙抗平臺,如金斯瑞SMABody平臺、藥明生物WuXiBody平臺、友芝友生物的YBODY平臺等。國內雙抗平臺的搭建如火如荼,目前已進入高速發展階段,大量專案進入臨床階段,相信在不久的將來,會有越來越多的雙特異性抗體在臨床中展示其開發優勢和治療價值。
參考文獻
1. rinkmannUlrich,Kontermann Roland E, Bispecific antibodies.[J] .Science, 2021, 372:916-917.
2. SyedYahiya Y,Amivantamab: First Approval.[J] .Drugs, 2021, 81: 1349-1353.
Romero Diana,Amivantamab is effective inNSCLC harbouring EGFR exon 20 insertions.[J] .Nat Rev Clin Oncol, 2021.
3. YUEYali, YIN Jun,GAOXiangdong,etal. Research advances of bispecific antibody drugs in tumor therapy[J].JChina Pharm Univ, 2019, 50( 3):289-298.
4. NisonoffA, Wissler FC, Lipman LN. Properties of the major component of a peptic digestof rabbit antibody. Science, 1960, 132(3441): 1770-1771.
5. MilsteinC, Cuello AC. Hybrid hybridomas and their use in immunohistochemistry. Nature, 1983, 305(5934): 537-540.
6. HolligerP, Prospero T, Winter G. “Diabodies”: small bivalent and bispecific antibodyfragments. Proc Natl Acad Sci USA, 1993,90(14): 6444-6448.
7. LindhoferH, Mocikat R, Steipe B, et al. Preferential species-restricted heavy/lightchain pairing in rat/mouse quadromas. Implications for a single-steppurification of bispecific antibodies. J Immunol, 1995, 155(1): 219-225.
8. https://www.amgenscience.com/
9. https://www.immunology.org/
10. https://www.hemlibra.com/
11. https://www.cortellis.com/