關注行研| 核酸藥物行業研究(二)——核酸藥物開發關鍵技術,獲取最新行業資訊。
近年來,核酸藥物獲批上市的速度呈加速趨勢,多款有潛力成為重磅藥物的核酸藥物公佈了臨床資料,覆蓋了心臟與代謝性疾病、肝臟疾病以及多種罕見病等領域,核酸藥物引發了較多的關注,有望成為繼小分子化藥和抗體藥物後的第三大型別藥物。在行研| 核酸藥物行業研究(一)——概況及發展過程中,小編綜述了核酸藥物的分類及發展歷程,本篇推文接上篇繼續分享核酸藥物開發的關鍵技術。
化學修飾技術可增強核酸藥物的穩定性和降低免疫原性。由於核酸的不穩定性以及人體記憶體在很多核酸酶,外源的核酸進入人體後很容易被降解,且易透過腎臟清除,半衰期較短;同時外源的核酸分子具有免疫原性,會引起人體的免疫反應等。研究證明,對核苷酸進行的化學修飾可改善上述問題,包括對核糖、磷酸骨架、鹼基以及核酸鏈末端等。
1. 磷酸骨架修飾
磷酸骨架最常用的化學修飾是硫代磷酸,即將核苷酸中磷酸骨架中的一個非橋氧用硫進行替代(PS改造),PS改造基本不影響核酸藥物的活性,但可以抵抗核酸酶的降解,而且該改造可增強其與血漿蛋白的結合能力,降低腎臟清除速率,提高半衰期。經過PS修飾還會增加小核酸與細胞內蛋白質(例如,核仁素)的相互作用,促進其在細胞核中的積累,利於細胞核內靶點的作用。
在PS鍵中引入額外的硫原子會導致在每個修飾的磷原子上產生手性中心,並形成兩種可能的立體異構形式(分別指定為Sp和Rp),不同手性的化合物活性可能大有差異,目前批准或正在開發的寡核苷酸藥物的外消旋混合物含有許多低活性的立體異構體,從而降低了整體混合物的整體效能,鑑定活性最高的立體異構體可能成為寡核苷酸藥物開發的重要手段使低劑量和更有效的化合物成為可能。
PS 是第一代 ASO 藥物中常見的化學修飾,現在依然經常在核酸藥物中使用。但經過 PS 改造後,核酸藥物與互補核苷酸鏈的親和力會變差,因此需要後續的化學修飾來改善。
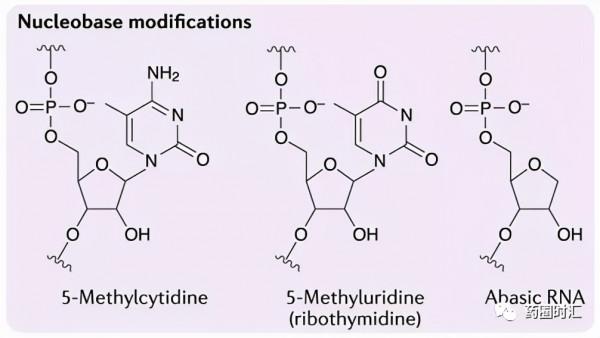
2. 鹼基改造
雖然核酸藥物對鹼基改造的耐受性較差,但對鹼基的改造也在嘗試中,如胞嘧啶甲基化可提高其解鏈溫度,已被應用在 ASO 藥物的設計之中(Ionis Pharmaceuticals在研藥物),無鹼基核苷酸(abasic)已被用於消除miRNA樣沉默。
3. 核酸鏈末端修飾
siRNA 5′末端的磷酸化對於活性是必不可少的,因為該基團在AGO2蛋白(RNA誘導沉默複合體的核心成分,具有核糖核酸內切酶活性,可透過促進微RNA的成熟並調節其生物合成及功能,進而抑制靶基因的表達,在多種病理生理過程中起關鍵性作用)的結構域中有重要的作用,細胞磷酸酶會降解末端磷酸基團,使得siRNA效力降低。
加入5′-(E)-乙烯基膦酸酯修飾起到了磷酸鹽模擬物的作用,可以防止 5′末端被核酸外切酶的降解和增強體內沉默。類似地,末端反向的abasic核糖核苷酸已被用於阻斷核酸外切酶活性。3’端新增反式胸苷(inverted thymidine),或者在末端新增軟脂酸或偶聯芳香化合物也可以避免核苷酸鏈被核酸外切酶降解。
4. 核糖修飾
第二代的化學修飾主要集中在核糖的結構中,對核糖結構中 2 位的羥基/氫進行改造。2’-O-甲基(2’-OMe),2’-O-甲氧基乙基(2’-MOE)和2’-氟(2’-F)是最常用的2’位羥基/氫的取代基。這些修飾可以增加寡核苷酸核酸酶的抗性,從而提高血漿中的穩定性,增加組織的半衰期,延長藥物作用時間。此外,這些修飾還能增強了寡核苷酸對互補RNA的結合親和力,2’-OMe修飾還可以消除ASOs、siRNAs和CRISPR guide RNAs誘導的免疫應答。
5. 核糖五元環改造
對核糖的五元環進行改造被稱為第三代的化學修飾,包括橋聯核酸鎖核酸BNAs、肽核酸PNA、磷醯二胺嗎啉代寡核苷酸PMO,這些改造可以進一步增強核酸藥物對核酸酶的抵抗、提高親和力和特異性等。
由於 PNA和 PMO 為電荷中性,其與血漿蛋白結合能力較弱,因此容易被清除,半衰期較短,但其可以與一些基團共價結合以提高核酸藥物進入細胞的效率,包括脂類、肽類、適配體、抗體以及 GalNAc 等。
1)橋連核酸(BNAs)
核糖糖的摺疊透過2'和4'碳原子之間的橋連被限制在3’-endo構象中而形成橋連核酸(BNAs),包括鎖核酸(LNA)、受2',4'約束的2'-O-乙基橋聯核酸(cEt)、2'-O,4'-C乙烯橋連核酸(ENA),橋連核酸增強了核酸酶的穩定性,增強了寡核苷酸對靶RNA的親和力。
通常對於鎖核酸,每個修飾核苷酸的解鏈溫度提高3-8℃,已有公司將橋連核酸用於改善與靶標的結合,也已用於空間位阻ASOs中,例如,Miravirsen(來自丹麥製藥商Santaris,後被羅氏收購,用於治療乙肝病毒的小核酸藥物)和Cobomarsen(miRagen公司研發,靶向miR-155的寡核苷酸抑制劑,擬開發治療面板T細胞淋巴瘤)都用到了LNA修飾。
2)磷醯二胺嗎啉代寡核苷酸(PMO)
核酸的五元核糖雜環被六元嗎啉環取代開發出與天然核酸結構大不相同的磷醯二胺嗎啉代寡核苷酸(PMO)也是常用的改造方法。迄今為止,FDA已經批准了兩種PMO藥物eteplirsen和golodirsen,它們分別靶向肌營養不良蛋白mRNA的外顯子 51和53,治療杜氏肌營養不良症(遺傳性肌肉萎縮病),Sarepta公司也在用該修飾方法進一步開發基於靶向肌營養不良蛋白外顯子的ASO產品。
3)肽核酸(PNA)
肽核酸(PNA)是用偽肽聚合物骨架替代了DNA/RNA的磷酸核糖骨架生成的核酸模擬物,PNA為不帶電荷的核酸分子,因此它們可以與帶電荷的促遞送基團(例如細胞膜穿透肽CPPs)共價綴合。但是,PNA與血漿蛋白的相互作用極小,這意味著它們可透過尿排洩迅速清除。
還有一種被稱為tricyclo-DNA (tcDNA)的限制型DNA類似物,可將RNA靶標-寡核苷酸雙鏈體的穩定性提高2.4℃。而且已有實驗顯示,系統給藥tcDNA 的ASOs在大腦中表現出活性,表明這些分子具有跨越血腦屏障(BBB)傳遞寡核苷酸的能力。
參考資料:
【1】中金公司-醫藥生物行業主題研究:核酸藥物,時代已至
【2】廣發證券-醫藥生物行業生物藥前沿研究系列之RNA靶向藥物:後單抗時代新浪潮
【3】Advances inoligonucleotide drug delivery. Nat RevDrug Discov. 2020 Oct; 19(10):673-694.
【4】Opportunities forInnovation: Building on the success of lipid nanoparticle vaccines. Curr Opin Colloid Interface Sci. 2021May 29; 101468.
【5】Lipid Nanoparticles Enabling Gene Therapies: From Concepts toClinical Utility. Nucleic Acid Ther. 2018 Jun; 28(3):146-157.
【6】各公司官網
注:本文旨在介紹醫藥健康行業研究進展,不是治療方案推薦,如需獲得治療方案指導,請前往正規醫院就診。
宣告:本公眾號旨在傳播醫藥行業相關資訊和研究報告,對券商研究報告進行文字整理,且註明參考來源,不涉及商業用途,特此宣告。