人類的DNA與黑猩猩非常相似,從進化的角度來看,黑猩猩是在親緣關係上與人類最接近的生物。如今,在一項新的研究中,來自瑞典隆德大學的研究人員發現了人類DNA中一個以前被忽視的部分,即所謂的非編碼DNA,似乎在人類和黑猩猩的大腦之間導致了一種差異,這可能解釋了為什麼人類和黑猩猩的大腦工作方式不同。相關研究結果於2021年10月7日線上發表在Cell Stem Cell期刊上,論文標題為“A cis-acting structural variation at the ZNF558 locus controls a gene regulatory network in human brain development”。
已有研究表明從進化上看,人類和黑猩猩來自於一個共同的祖先。大約500萬至600萬年前,人類和黑猩猩的進化路徑發生分叉,導致了今天的黑猩猩和21世紀的人類---智人。
在這項新的研究中,這些作者研究了了我們的DNA中是什麼使人類和黑猩猩的大腦不同,他們已經找到了答案。
論文通訊作者、隆德大學神經科學教授Johan Jakobsson解釋說,“我們並沒有研究活的人類和黑猩猩,而是使用在實驗室中培養的誘導性多能幹細胞(iPSC)。iPSC是由我們在德國、美國和日本的合作伙伴對面板細胞進行重程式設計獲得的。隨後,他們讓所獲得的ipsC在體外發育為前腦神經祖細胞(forebrain neural progenitor cell, fbNPC)並研究了fbNPC。”
透過比較利用人類和黑猩猩ipsC分別產生的人類fbNPC和黑猩猩fbNPC,這些作者發現人類和黑猩猩以不同的方式使用其DNA中的可變數目串聯重複序列(variable number tandem repeat, VNTR),這似乎在人類和黑猩猩的大腦發育中發揮了相當大的作用。
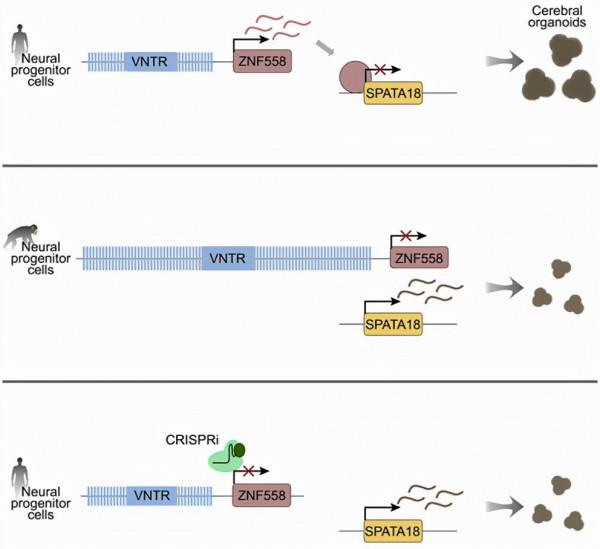
圖片來自Cell Stem Cell, 2021, doi:10.1016/j.stem.2021.09.008。
這些作者確定了一種KRAB-ZFP轉錄因子:ZNF558,它在人類而不是黑猩猩的fbNPC中表達。ZNF558是作為LINE-1轉座子的抑制因子而進化出來的,但已被用來調節單個靶標,即線粒體自噬基因SPATA18。ZNF558線上粒體穩態中起作用,在大腦類器官中的功能缺失實驗表明,ZNF558在人類早期大腦發育期間影響發育時間。ZNF558的表達受到下游的VNTR大小的控制,黑猩猩的VNTR比人類更長,而且VNTR在人類群體中也是可變的。因此,這項研究為順式結構變異(cis-acting structural variation)如何建立一種影響人類大腦進化的調控網路提供了機制上的新見解。
VNTR是一種所謂的DNA結構變體,以前被稱為‘垃圾DNA’,一種長期被認為沒有功能的DNA重複序列。以前,科學家們一直在DNA中製造蛋白的基因部分尋找答案,這些基因只佔人類基因組的2%,並研究了蛋白質本身,以找到差異。
因此,這些新的發現表明,人類和黑猩猩的大腦發育差異似乎在基因組DNA的蛋白編碼基因之外的稱為‘垃圾DNA’的地方,這在之前被認為是沒有功能的,而且構成了基因組DNA的大部分(98%)。
Jakobsson說,“這表明,人類大腦進化的基礎是遺傳機制,這些機制可能比以前認為的要複雜得多,因為人們之前認為答案就在2%的遺傳DNA中。我們的結果表明,對大腦發育有意義的東西反而可能隱藏在被忽視的98%中,這似乎很重要。這是一個令人驚訝的發現。”
這些作者所使用的幹細胞技術是革命性的,使這種型別的研究得以進行。正是日本研究人員山中伸彌的發現使得特化細胞可以被重程式設計成iPSC,隨後iPSC可以分化為幾乎所有型別的細胞。在這項新的研究中,ipsC分化為fbNPC。如果沒有這種技術,就不可能用符合倫理的方法研究人類和黑猩猩之間的差異。
為什麼想要研究人類和黑猩猩之間的差異?
Jakobsson說,“我相信,大腦是瞭解人類之所以為人的關鍵所在。人類能夠以這樣的方式使用他們的大腦來建立社會,教育他們的孩子並發展先進的技術,這是怎麼來的?這很吸引人!”
Jakobsson認為,在未來,這些新的發現也可能有助於對有關諸如精神分裂症之類的精神疾病的問題提供基於遺傳上的答案,其中精神分裂症似乎是人類獨有的。
他總結說,“但是在我們達到這一點之前還有很長的路要走,因為我們現在不是對2%的編碼DNA進行進一步的研究,而是可能被迫深入研究100%的DNA---這是一項相當複雜的研究任務。”(生物谷 Bioon.com)
參考資料:
Pia A. Johansson et al. A cis-acting structural variation at the ZNF558 locus controls a gene regulatory network in human brain development. Cell Stem Cell, 2021, doi:10.1016/j.stem.2021.09.008.