弗朗茲-烏爾裡希·哈特爾(左) 、亞瑟·霍里奇(右)
▼
因在蛋白質摺疊的分子機制上的貢獻,馬克斯·普朗克生化研究所主任、德國生物化學家弗朗茲-烏爾裡希·哈特爾(Franz-Ulrich Hartl,1957-)與耶魯大學醫學院的美國生物學家亞瑟·霍里奇(Arthur L. Horwich,1951-)幾乎已經拿下了除諾獎外所有的生物化學及相關學科的國際大獎。
2011年,即屠呦呦獲得拉斯克獎(The Lasker Awards)臨床醫學獎的同一年,哈特爾和霍里奇也獲得了拉斯克基礎醫學獎。2020年,哈特爾和霍里奇又摘取另一諾獎風向標——美國生命科學突破獎,是諾獎預測名單上的常客。
蛋白質的摺疊機制是重要的生物學問題。《知識分子》特別推出“諾獎值得”系列專欄,向讀者介紹那些重要的科學發現及其背後的故事。
Talent hits a target no one else can hit; genius hits a target no one else can see.
人才及凡人所不能及,天才及凡人所不能見。—— 叔本華
撰文 | 王宗安(芝加哥大學計算化學博士)
責編 | 劉楚
● ● ●
哈特爾的兩大愛好
弗朗茲-烏爾裡希·哈特爾出生於1957年的西德工業城市埃森(Essen),四歲時隨父母搬遷到黑森林(Black Forest)北部的一個小鎮。在林野間,捉蛙捕螈,蹚溪築壩,哈特爾度過了美好的童年。自五歲,哈特爾開始學習樂譜,先後學會了木笛、長笛和鋼琴,音樂成為了他保持終身的兩大愛好之一。另一個愛好嘛,是生物學!確切地說,哈特爾對生物學的興趣是捕捉、收集昆蟲,製作標本,用顯微鏡觀察。“引他入坑” 的是他的爺爺,一位業餘顯微鏡大拿。進入高中後,哈特爾找到了新的愛好:生物化學。[1]
19歲,哈特爾進入海德堡大學(Heidelberg University)醫學院學醫。在完成必要醫學訓練的同時,哈特爾在生物化學系進修博士學位。期間,他發現肝細胞的一類細胞器過氧化物酶體(peroxisome),可以被甲狀腺激素代謝啟用並誘發大量增殖 [2]。
1985年,哈特爾的博士論文被送給慕尼黑大學的著名細胞生物學家瓦爾特·諾佩特(Walter Neupert,1939 - 2019)[3]評審。諾佩特很賞識這篇論文,邀請哈特爾來自己的實驗室做博後研究—— 這成為了哈特爾人生至關重要的轉折。
對哈特爾而言,這個轉折有雙重意義。一方面,導師諾佩特在1986年將他派往希臘參加分子生物學暑期學習,令他結識了未來的生活愛侶和科學良助瑪納吉特(Manajit);另一方面,在諾佩特實驗組研究線粒體吸收(import)新合成蛋白,催生了其分子伴侶的工作。
哈特爾與夫人瑪納吉特於2020年領取生命科學突破獎 | 照片版權:Miikka Skaffari
蛋白質摺疊的安芬森法則
我們先談談蛋白質在細胞內怎麼摺疊。
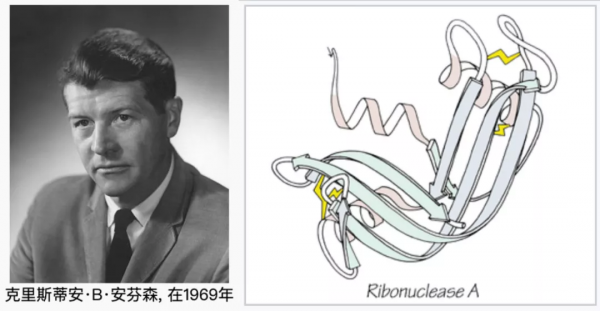
1972年的諾貝爾化學獎得主克里斯蒂安·伯默爾·安芬森(Christian Boehmer Anfinsen, 1916 – 1995)曾這樣猜想:小的水溶性蛋白質在生理環境條件下的天然結構僅取決於其氨基酸序列 [4]。這被稱為安芬森法則(Anfinsen’s dogma),也被稱為蛋白質摺疊的熱力學猜想(thermodynamic hypothesis)。
安芬森法則是今日蛋白質結構的計算預測的基石,說是公設也可以,是不容置疑的、需要提前承認的法則——在此公設框架下進行計算預測。
安芬森本人是基於對核糖核酸酶(ribonuclease A)的研究做出上述假說的。他觀察到,令純化的有生理活性的酶變性以至於其多肽長鏈開啟(unfold),之後透過稀釋溶液降低變性劑濃度,已經去摺疊的蛋白會自發地重新獲得酶活性。這表明,酶自發地、正確地摺疊回去了,即,酶的氨基酸序列足以特異性地決定其三維結構以及酶活功能。
更明白地說,酶的摺疊不需要其它蛋白質的協助,也無需輸入額外的能量(如ATP)。
如此簡潔、明白、優美的物理理解在當時並不容易被接受,甚至可謂石破天驚。多年後本文的另一位主人公——亞瑟·霍里奇回憶 [5],“安芬森得諾獎時,自己與實驗室的組員連著討論了好多天,簡直讓人驚呆了,安芬森真膽大包天啊,怎麼會期待讓變了性的蛋白再摺疊回去、恢復功能?”
當然安芬森法則所描述的摺疊發生於所謂 in vitro(體外)實驗條件下。在細胞內的蛋白質摺疊,即 in vivo(體內),即使基本法則不變,情況也複雜得多得多。
大家可以想象:一個接一個的氨基酸在蛋白質的製造工廠 —— 核糖體內被綴鏈到一起,生成一個新的蛋白;這個新蛋白,猶如一段擠出來的牙膏,離開核糖體,進入細胞質(cytosol)。這個還沒有摺疊的蛋白質長鏈上的一些氨基酸殘基又油又黏,另一些則又潤又滑。油膩的殘基傾向於聚合而包埋到蛋白質內部,水潤的殘基傾向於暴露朝外,與外部水溶液接觸。
現在問題來了:細胞內非常擁擠,充滿了各種摺疊的、半摺疊的、未摺疊、甚至錯誤摺疊的蛋白質分子,如何能保證自己的摺疊不受旁邊分子的干擾呢?
發現摺疊酶
自60年代安芬森提出蛋白質摺疊的熱力學假說,近30年間,基石般的法則左右了整個生物學界對待蛋白質摺疊問題的態度。哈特爾回憶 [5],“細胞生物學家就是對蛋白質摺疊不感興趣,這是研究試管裡蛋白質自發反應的生物物理學家和生物化學家的領域。”
直到80年代末,兩位年輕人的科研軌跡相互交叉。
年齡稍大的霍里奇結束兒醫住院醫師訓練後回到耶魯大學,加入了醫學院院長里昂·羅森博格(Leon Emanuel Rosenberg,1933-)的課題組。仍然對蛋白摺疊心心念唸的霍里奇希望能挑一個兒科病,結合當時已有的DNA重組技術,從分子生物學角度闡明它的致病機理。他瞄上的是一種罕見的X染色體遺傳病:鳥胺酸氨甲醯基轉移酶(ornithine transcarboxylase deficiency,OTC)缺乏症。OTC是一種線粒體酶。遺傳有這種致命疾病的新生兒不能正常代謝尿素,血氨增高。
霍里奇研究發現 OTC 在細胞溶膠內合成,然而必須要進入線粒體,才能發揮功能。利用酵母作為載體篩查人體酶的基因突變,他發現一種特殊的酵母突變體能夠將OCT運輸入線粒體,但是OTC卻沒有酶活。那麼這時可能有兩種情況:(1)OTC其實沒有真正進入線粒體;(2)OTC進入了線粒體,但沒有正確摺疊,因而無法發揮催化功能。
話分兩頭。此時大西洋的另一邊,哈特爾剛剛開始研究蛋白質在細胞內的輸運,特別是蛋白質如何進入線粒體。在研究過程中,哈特爾認識到,蛋白質必須先開啟,進入線粒體之後再重新摺疊功能狀態。—— 這可不巧了嘛,霍里奇和哈特爾的研究互補了!
蛋白質進入線粒體示意圖[6]
1988年,哈特爾的導師諾佩特給霍里奇打了一個越洋電話。霍里奇幾乎放下電話就去買了飛往慕尼黑的機票。[5]
面對霍里奇帶來的結果,諾佩特和學生們儘管感到很興奮,卻依舊保持懷疑 —— 如果要證明存在一種輔助OTC摺疊的蛋白質,必須要證明 OTC 完全進入了線粒體,因為OTC可能在穿過線粒體膜的過程中“卡住”,而這種情況下呈開啟狀態的OTC可能會被從中切斷而失去活性。—— 這時,哈特爾主動請纓,自己來做這個實驗。
僅僅幾周,哈特爾就做出實驗結果—— OTC的確完全進入了線粒體。這意味著,線粒體內確實存在一種摺疊酶(foldase)。哈特爾、霍里奇以及諾佩特等人於1989年在 《自然》上發表了兩篇標誌性論文 [7-8]:安芬森法則統治蛋白質摺疊的時代結束了。
哈特爾在32歲用了幾個星期做出了讓他在日後蜚聲科學界的工作。
文獻 [7] 證明一種名為hsp60的線粒體內的熱休克蛋白在進入線粒體的蛋白的組裝過程中起關鍵作用。因為 hsp60 符合約翰·埃利斯(John Ellis)在1987年對 “分子伴侶”(molecular chaperone)的定義,所以被歸納為一種分子伴侶蛋白。[9] 這篇論文的首作者鄭明媛(CHENG Ming Y.,右上角)是霍里奇的最早的研究生之一, 現已從臺灣省國立陽明大學生命科學系暨基因體科學研究所退休。霍里奇形容她為 “無所畏懼的實驗學家”。[10-11]
文獻 [8] 則進一步證明線粒體內的蛋白質摺疊必須要hsp60,並且消耗ATP水解的能量。
分子伴侶:熱休克蛋白
哈特爾和霍里奇一同榮獲過許多獎項,包括2011年的拉斯克基礎醫學研究獎。荷蘭遺傳學細胞生物學家、洛克菲勒大學教授蒂蒂亞·德朗厄(Titia de Lange)是二人獲得拉斯克獎的現場介紹人。
德朗厄在介紹二人獲獎工作時做了一段很精妙的比喻,來說明熱休克蛋白hsp60的功能:
“Hsp60體系像一座監獄能夠將蛋白質囚禁在單人牢房—— 這就像是美國的監禁制度(American penal system),只是去掉了無人道的(inhumane)部分,並且更加高效。Hsp60形如圓桶,抓住去摺疊蛋白分子的黏性部分,將之拽入桶內,並關閉桶蓋。此時陷入hsp60的蛋白分子嘗試各種姿態構象進行摺疊,而不必碰撞其它蛋白質分子。Hsp60的桶壁高度帶電。蛋白質分子被關押在桶內約10秒,可以想象,它在此過程中掙扎、扭動,碰撞牆壁,直至桶門開啟。越獄犯可能完成了正確摺疊,成為了細胞內茫茫蛋白中的一位好好公民,也可能還沒有完成摺疊。那麼這樣的累犯會迅速被捕獲、押解入另一個囚籠。這個先擒後縱的過程可能往復十次,才最終令一條多肽鏈正確摺疊,進而獲得保釋,允許出獄,如同一個模範公民,去履行自身的職責,再也不與其它蛋白質分子有非分接觸。”
“哈特爾和霍里奇的工作大大加深了我們對細胞生命功能的理解,在醫學、藥學方面有廣泛應用。幾乎所有蛋白質在其熟化(maturation)過程中都需要分子伴侶的某種形式的參與,而幾乎所有生命體都使用 “單獨囚禁” 的方式驅策它們的一部分蛋白正確摺疊。分子伴侶-輔助的蛋白質摺疊給我們提供許多洞見,以理解因蛋白變異而導致的疾病,如阿爾茨海默症、帕金森症、盧·賈裡格症(又稱肌萎縮性脊髓側索硬化症、漸凍症)等。” [6]
Hsp60-Hsp10 分子伴侶複合體功能示意圖[12]
哈特爾的學術家譜
筆者敘述科學家事蹟有一個習慣:總免不了考察他的學術家譜。哈特爾是德國培養的科學家,在當前美國的生命科學整體領先歐洲及東亞的大背景下,追索一下他的師承脈絡,可能會給我們帶來一些有益的啟發。
哈特爾的學術生涯裡先後有三位導師:博士導師、化學家、海德堡大學醫學院教授 Hans Schimassek,博後導師、細胞生物學家、慕尼黑大學教授瓦爾特·諾佩特,博後導師、生物化學家、達特茅斯學院教授威廉姆·維克納(William T. Wickner)[12]。
哈特爾曾自述在諾佩特教授處的經歷是其人生重大轉折,那麼我們重點攀著諾佩特的師承譜系樹上行看一看。
筆者根據 academictree.org、維基百科、nobelprize.org 等網站整理,自最左諾佩特向右顯示了學術代際繼承關係,黑色箭頭附近的紅色字體表明導師與學生的具體關係以及前者指導後者的時間。每位科學家所屬的主要領域寫在其生卒年下方。特別地,我用藍色字型標出學生在導師處的主要研究方向;例如,諾佩特在其博士導師西奧多·布夏(Theodor Bücher)處的主要工作是研究線粒體的形成與形態。[13]
這張圖展現的7位科學家中,有幾位的名字格外響亮。
奧托·海因裡希·瓦爾堡(Otto Heinrich Warburg)因為其對呼吸酶的發現和研究而榮獲1931年諾貝爾生理學醫學獎。
赫爾曼·埃米爾·費歇爾(Hermann Emil Fischer)因為其對嘌呤和糖類的合成而榮獲1902年諾貝爾化學獎,但他更出名的是以其名字命名的費歇爾投影式(Fischer projection),本科有機化學課必講內容。
奧古斯特·凱庫勒(August Kekulé)可能更著名一些,畢竟苯環的凱庫勒式(Kekulé structure)進入的是高中課本,甚至他的夢(Kekulé's dream)—— 因為夢見頭尾相銜的蛇(ouroboros)而想出了苦苦思索的苯環結構,都進入了高中教材。
阿道夫·馮·拜爾(Adolf von Baeyer)因為合成靛藍(indigo)而榮獲1905年諾貝爾化學獎,落後於他的博士生費歇爾,沒辦法學生太優秀了;他還發現了酚酞,進入了初中教材。
我們可以看到,費歇爾→瓦爾堡→布夏→諾佩特→哈特爾,他們的研究一脈相承,漸次推進,非常連貫。瓦爾堡在博士期間細緻地研究多肽分子在與呼吸有關的氧化反應中發揮的作用和代謝機理,並且由於自己的醫學背景,使得布夏在博士期間致力於理解血紅蛋白的氧化還原反應;進而,當諾佩特開始讀博,研究細胞呼吸作用的線粒體如何形成、如何功能則成為當時細胞生物學的研究焦點;接著,哈特爾恰逢其會地由對線粒體輸運蛋白的研究發現分子伴侶。順理成章。
參考文獻:
[1] Autobiography of Franz-Ulrich Hartl (2012)
[2] Die Steuerung peroxisomaler Enzymaktivitäten durch Schilddrüsenhormon in der Leber der Ratte. DNB 850819857, Dissertation, Heidelberg 1985.
[3] Obituray: Water Neupert (1939 – 2019), Cell 178, August 22, 2019
[4] Principles that Govern the Folding of Protein Chains, Science 181 (1973) 223-230
[5] A mystery unfolds: Franz-Ulrich Hartl and Arthur L. Horwich win the 2011 Albert Lasker Basic Medical Research Award
[6] laskerfoundation.org/winners/chaperone-assisted-protein-folding/
[7] Nature 337 (1989) 620
[8] Nature 341 (1989) 125
[9] John Ellis, Proteins as molecular chaperones, Nature 328 (1987) 378
[10] Arthur L. Horwich, Chaperonin-mediated Protein Folding, J. Biol. Chem. 288 (2013) P23622
[11] dls.nycu.edu.tw/faculty/faculty-member.html
[12] atlasgeneticsoncology.org/Genes/GC_HSPD1.html
[13] academictree.org/cellbio/peopleinfo.php?pid=57559