腫瘤的發展與腫瘤微環境息息相關,腫瘤微環境高度動態且複雜,其中有許多還未發現的作用。而免疫細胞作為腫瘤微環境的關鍵角色,已經為腫瘤治療帶來了前所未有的突破,例如免疫檢查點阻斷以喚醒T細胞。然而如此之好的療效僅有部分個體受益,其他個體仍存在治療抵抗。在導致治療抵抗的因素中,腫瘤微環境尤為關鍵,比如腫瘤微環境中的先天免疫細胞包括吞噬細胞,即單核細胞和巨噬細胞,以及樹突狀細胞等,在宿主防禦、組織內穩態和修復中發揮重要作用。
癌症治療最令人畏懼的障礙就是克服免疫抑制性腫瘤微環境。人體腸道微生物群影響腫瘤微環境中抗腫瘤免疫及對免疫治療的反應,最近有研究表明癌症患者微生物群對免疫檢查點阻斷反應存在關聯【1,2】,但是分子基礎不明。究其原因可能是因為前期研究的著眼點都放在了T細胞上,而對於微生物群是否調節先天免疫細胞的功能還不清楚。
2021年10月7日,美國國立衛生研究院國家癌症研究所的Romina S. Goldszmid研究小組在Cell雜誌上發表題為The microbiota triggers STING-type I IFN-dependent monocyte reprogramming of the tumor microenvironment的研究論文,在這篇研究論文中,作者發現人體微生物群透過STING-type I IFN依賴機制調節腫瘤微環境的促腫瘤/抗腫瘤平衡,重程式設計腫瘤內單核吞噬細胞以促進抗癌免疫和免疫檢查點阻斷法的療效。
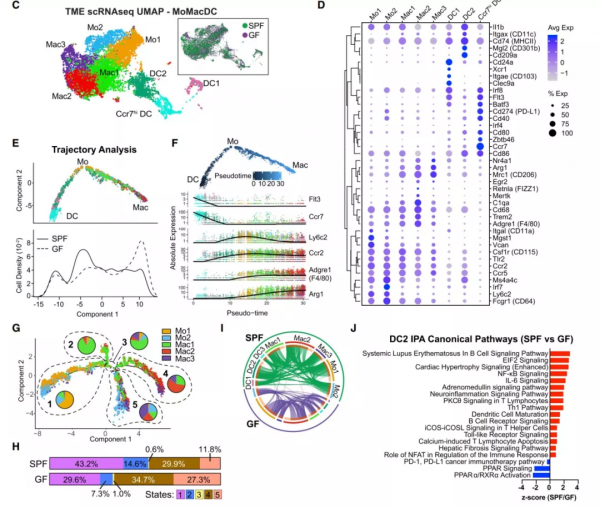
在這項研究中,作者在臨床前淋巴瘤中進行了單細胞分析、微生物群擾動(microbiota perturbation)分析和功能細胞表徵分析。作者首先發現單核吞噬細胞的可塑性很強,微生物訊號將腫瘤微環境中的單核吞噬細胞重程式設計為免疫刺激性單核細胞和樹突狀細胞。單細胞RNA測序顯示,微生物群的缺失以犧牲單核細胞和樹突狀細胞為代價,使腫瘤微環境向致瘤性巨噬細胞轉移(圖1)。
圖1:微生物群重塑腫瘤微環境中的單核吞噬細胞。
作者接下來的機制探索表明,微生物群衍生的干擾素基因刺激因子(STING)激動劑(例如c-di-AMP)引起了單核吞噬細胞重程式設計,透過腫瘤內單核細胞誘導I型干擾素(IFN-I),從而調節巨噬細胞極化,以及自然殺傷(NK)細胞-樹突狀細胞相互作用。
由此作者提出疑問,對微生物群進行飲食控制是否能成為臨床上重程式設計腫瘤微環境的新方法?於是作者給小鼠飼餵了高纖維的飲食,發現IFN-I的產生增加了,腫瘤微環境中的單核吞噬細胞也得到了重塑,增加了樹突狀細胞並改善了抗腫瘤反應,同時,免疫檢查點阻斷的療效也大幅提高。這項發現與最近的一些臨床研究相符【3,4】。後續研究發現,富含纖維的阿克曼菌(Akkermansia muciniphila)能夠產生c-di-AMP並出現和高纖維飲食相同的結果。
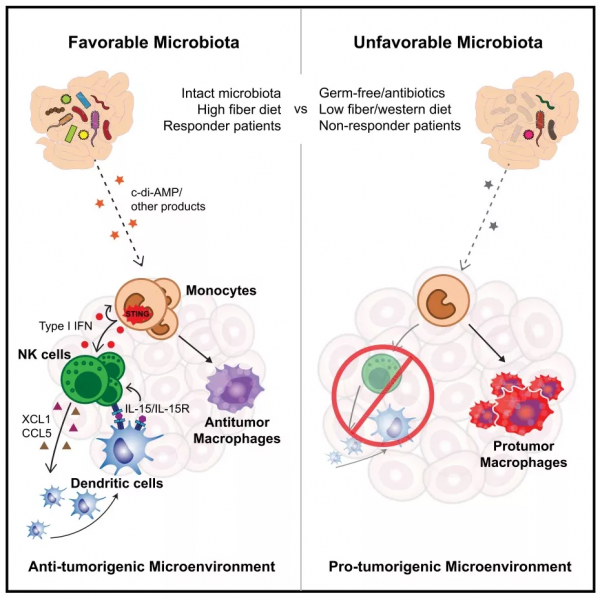
圖2:微生物群移植。
在黑色素瘤患者中,作者再次驗證了前面的發現。免疫檢查點阻斷應答者的微生物群誘導 IFN-I產生,並重塑先天免疫腫瘤微環境;同時,透過糞便微生物群移植也可以觸發IFN-I產生,並重程式設計腫瘤內單核吞噬細胞以促進抗癌免疫和免疫檢查點阻斷療效(圖2)。這些觀察結果強有力地支援微生物群、IFN-I和免疫檢查點阻斷反應之間的因果關係。人體微生物群協調腫瘤中IFN-I和先天免疫腫瘤微環境重程式設計。
綜上所述,這項研究發現微生物群衍生的STING激動劑透過腫瘤內的單核細胞誘導IFN-I的產生,從而使腫瘤微環境更加有利於抗腫瘤;這些單核細胞調節NK細胞的募集和啟用、以及隨後的NK細胞-樹突狀細胞相互作用(圖3左);當微生物群受到破壞時,單核細胞-IFN-I-NK細胞-樹突狀細胞的級聯反應停止,單核細胞分化為促腫瘤巨噬細胞(圖3右);透過高纖維飲食調節微生物群、或透過產c-di-AMP菌、或來自免疫檢查點阻斷應答者個體的微生物群移植都能夠促進IFN-I途徑、改善抗腫瘤反應、加強療效。
圖3:生物群觸發腫瘤微環境的STING-Type I IFN依賴性單核細胞重程式設計。
這項研究填補了微生物群如何調節腫瘤內單核吞噬細胞的空白。該研究揭示了微生物群與先天免疫細胞之間的複雜相互作用,以及微生物群形成腫瘤微環境先天免疫以調節抗腫瘤免疫的機制,為利用微生物群進行癌症治療帶來了啟發。
參考文獻
1. Chalabi, M., Cardona, A., Nagarkar, D.R., et al. (2020). Efficacy of chemotherapy and atezolizumab in patients with non-small-cell lung cancer receiving antibiotics and proton pump inhibitors: pooled post hoc analyses of the OAK and POPLAR trials. Ann. Oncol. 31, 525–531.
2. Chaput, N., Lepage, P., Coutzac, C., et al. (2017). Baseline gut microbiota predicts clinical response and colitis in metastatic melanoma patients treated with ipilimumab. Ann. Oncol. 28, 1368–1379.
3. Spencer, et al., 2019, AACR, abstract.
4. Richard et al., 2020, SITC, abstract