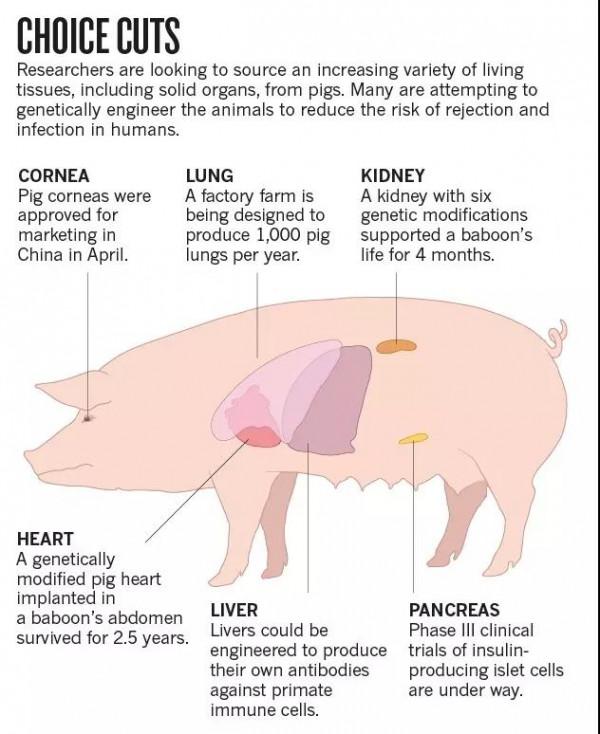
二十多年以來,科學家們一直在積極探索將豬的心臟、腎臟、肺臟等器官移植到病人體內的可能性,以緩解器官供體嚴重不足;一些大公司也紛紛加入異源器官移植研究領域,期望能在商業化應用方面佔得先機。
但是一些關鍵技術問題未能得到解決,導致異源器官移植研究陷入困境,其中面臨的最大挑戰就是如何解決異源器官移植後人體免疫系統幾乎必然會發生的超急性排異問題。
早在100多年前,就有人嘗試將豬的器官直接移植到病人體內,但均以失敗告終。原來人體與其它動物一樣,在漫長的進化過程中,形成了一套識別和清除外來組織器官的保護機制,即免疫排斥。
一旦有外來組織器官進入,動物體就會啟動免疫排斥反應,識別出外來的細胞、組織或器官,並啟動清除程式,嚴重時,幾分鐘或數小時內就會讓外來組織器官失活壞死,即超急性排斥反應,是異源器官移植面臨的最主要障礙之一。
不過,伴隨著基因編輯技術的發展,這一問題已經展現出了重大的突破。
基因編輯攻克超急性排異反應
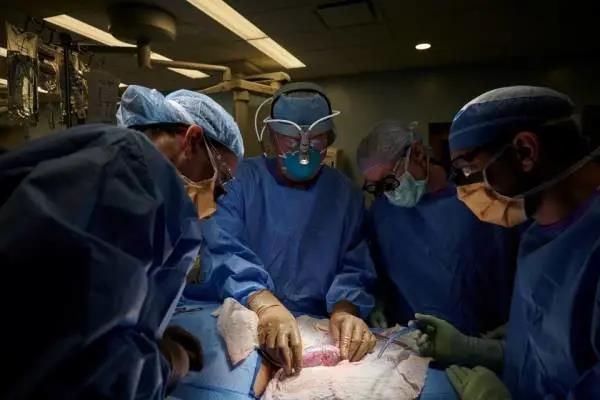
近日,美國研究人員成功嘗試了首例將豬腎植入人體的器官移植手術。一名腦死亡的腎病患者在紐約大學朗格尼醫學中心(NYU Langone Health)被植入豬腎後,其人體免疫系統三天內未出現所謂的超急性排異反應,該例手術也為將來潛在的人體動物器官移植帶來希望,有望解決目前的供體短缺問題。
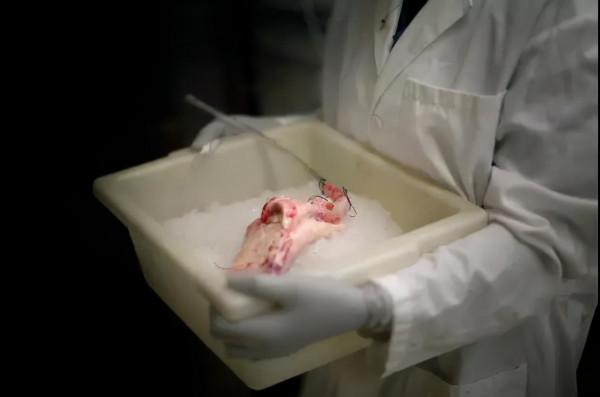
據路透社19日報道,紐約大學蘭貢醫療中心(NYU Langone Health)上月實施了手術。患者已經腦死亡,出現腎功能不全跡象。徵得患者家屬同意後,醫生把一個豬腎連線到患者的一對大血管上,豬腎留在患者體外,用於觀察手術效果。
主刀醫生羅伯特·蒙哥馬利(Robert Montgomery)說,由於移植豬腎經過基因改造,手術沒有立即引起排異反應。與患者血管相連後,豬腎正常發揮過濾廢物、產生尿液的作用,排尿水平與移植人類腎臟相當。患者手術前肌酐水平異常,在移植後恢復正常。肌酐水平是衡量腎功能是否健全的指標之一。
他說,豬細胞中一種名為alpha-gal的糖分子會引起人體排異反應,而這次手術的“腎源”是一頭經基因改造、去除這種糖分子的豬,因此患者沒有出現排異反應。移植手術後3天,患者生命支援裝置按預定日期去除。
手術獲得了患者家屬的同意,並在獲得家屬同意前徵詢了倫理和法律人士的意見。而開發這種被稱為“GalSafe”去半乳糖基因編輯豬的公司United Therapeutics,已於去年12月獲得美國FDA的批准,用於開發潛在的人體療法。
蒙哥馬利醫生表示,首例豬腎移植人體手術的成功將為腎功能衰竭晚期患者人體試驗鋪平道路,最快有望於未來1-2年開展人體試驗。這些動物器官可以為正在等待人體器官供體的重症患者提供短期的生命過渡支援。
他還表示,由於最新的試驗僅觀察了腎臟在人體內留存三天的情況,因此未來更大規模的人體試驗中可能會發現新的問題,並對技術提出新的挑戰。
不過FDA稱,從動物身上開發的醫療產品要用於人體,還需要獲得FDA專門的批准。其他潛在的療法還包括心血管類疾病以及植皮療法等。
異源器官移植那些你不得不知道的事兒
自上世紀50年代人類首次成功實施器官移植手術以來,對於那些遭遇致命性器官病變的患者來說,器官移植已經成為他們重獲新生的唯一希望。
但是異源器官移植又面臨著暫時無法攻破的壁壘,於是有科學家腦洞大開,想出一些巧妙的方法,想改掉人類這種頑固排他的“壞毛病”。
一、偽裝成“自己人”
當然要騙過靈長類動物的免疫系統並不是一件容易的事情,首先要將豬細胞表面特有的抗原成分去除,科學家研究發現,除了人類和其它靈長類動物之外,絕大多數哺乳動物的細胞表面都存在一種由α-1,3-半乳糖苷轉移酶催化產生的抗原表位,靈長類動物體內天然存在的抗體能特異識別這種抗原表位,是引起超急性免疫排斥反應的主要原因,如果能將調控該酶表達的基因去掉,豬器官表面則不會形成特異抗原表位;
其次,透過轉基因技術,讓豬的器官上皮細胞表達一些人的補體調節蛋白,將豬的器官人源化,人和其他靈長類動物則會誤認為是同類的器官,也可以避免或減輕超急性排斥反應。
2000年,英國研究人員將人CD55轉基因豬的腎臟移植到食蟹猴體內,移植物存活時間最長可達到139天;2005年,美國科學家將攜帶人CD46基因的轉基因豬的心臟移植到狒狒體內,結果移植物的最長存活時間可以達到109天。
這些研究表明,攜帶人源補體調節蛋白基因的轉基因豬器官可以有效克服超急性排斥反應,也具有移植到人體的潛力。
2016年4月,美國國立衛生研究院心胸外科研究專案團隊在《自然-通訊》上公佈了令人振奮的研究成果:
該團隊早在3年前就培育出一種攜帶人膜輔蛋白基因和人血栓調節蛋白基因,同時α-1,3-半乳糖苷轉移酶基因敲除的基因工程豬,研究人員取出上述基因工程豬的心臟,移植到五隻狒狒體內,藉助抗CD40單克隆抗體、CD20單克隆抗體,以及一些抗排斥藥物,豬的心臟在五隻狒狒體內平均存活298天,最長移植存活時間達945天,創造了最長的異源器官存活記錄。
二、讓豬的器官更安全
除了異源移植存活時間不夠理想之外,基因工程豬的器官一直沒有被允許用於人的臨床試驗,另一項重要的原因就是豬基因組含有大量內源性逆轉錄病毒基因。
早在2015年10月,美國《科學》雜誌發表了一篇中美科學家合作完成的重要論文,該論文一發表,很多頂級科學家紛紛表示這項研究有望重新開啟異源器官移植研究的黃金時代。
原來,來自中國的楊璐菡博士作為一個哈佛大學團隊的主要研究人員,根據豬的內源性逆轉錄病毒基因序列,設計了一種特殊的CRISPR-Cas9“基因剪刀”,成功將豬腎上皮細胞基因組中全部62個的內源逆轉錄病毒基因剪下失活,隨後研究人員將基因編輯後的豬細胞和人細胞在一起培養,發現豬病毒的侵染率只是未經基因編輯豬細胞的千分之一。
這也是國際上首次在全基因組實現內源性逆轉錄病毒基因的編輯剪下,使基因工程豬的異種移植研究前進了一大步。
如何看待器官移植?
上海市器官移植重點實驗室主任、上海醫學會器官移植分會主任委員朱同玉認為,對腦死亡患者去做這樣的器官移植試驗在倫理方面的爭議較小,但是未來是否能夠將試驗擴大到正常患者群體,仍然需要獲得更多關於試驗的科學資料。
“如果資料證明在人體的應用是安全的,那麼就能向未來人體試驗邁出更大的一步。”朱同玉對第一財經記者表示。
他援引資料稱,中國目前尿毒症患者超過一百萬人。最新資料顯示,中國登記的血透患者就有70萬人,對於腎臟供體需求巨大。朱同玉表示,儘管我國在臨床器官移植領域發展迅速,但在基礎研究方面,與美國相比還有一定差距。“所以我一直呼籲應該與國際接軌,加強器官移植基礎技術的投入和探索。”朱同玉說道。
朱同玉表示,藉助目前快速進步的基因編輯技術,在改造器官方面的技術已經比過去要更加成熟。此外,幹細胞培養組織器官再生也是一種途徑,未來心臟、肝臟等器官都可以採取這種方式。