作者丨崔雪芹
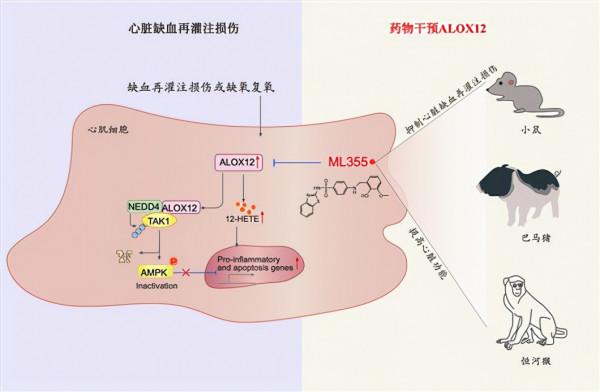
ALOX12促進心臟缺血再灌注損傷;小分子ML355顯著提高小鼠、豬、猴急性心肌缺血再灌注損傷預後。李紅良供圖
9月17日,武漢大學李紅良團隊在《細胞代謝》雜誌發表最新研究論文,研究者透過臨床樣本代謝組學篩選和系統功能學驗證,首次揭示了ALOX12(花生四烯酸12-脂肪氧化酶)是心臟缺血再灌注損傷的關鍵驅動分子,發現小分子化合物ML355可有效改善缺血再灌注引起的小鼠、巴馬豬和恆河猴的心肌損傷和心功能下降。
急性心肌梗死的高發病率、高死亡率是威脅人類生命健康的重大原因之一。血運重建療法(藥物溶栓、介入、搭橋等)是急性心梗的主要治療手段,能有效降低患者死亡率。但是,血運重建不可避免的引起缺血再灌注損傷,導致嚴重的心肌細胞死亡、組織損傷加重、急慢性心衰,甚至死亡。
據統計,心臟缺血再灌注損傷導致術後5年心血管不良事件發生率高達40%,死亡率高達9%~11%。在我國,血運重建治療不及時、缺血時間延長,進一步加重了心臟缺血再灌注損傷,嚴重影響患者預後和生存質量。然而,目前沒有任何藥物可以特異性改善臨床心臟缺血再灌注損傷,提高血運重建預後。
心臟缺血再灌注損傷發病機制複雜,但是源頭啟動因素和根本發病機制不明確,極大限制了特異性靶向治療藥物的開發。
李紅良團隊研究成果破解了這一難題。
該研究收集急性心梗病人PCI治療前後以及小鼠、巴馬豬、恆河猴心臟缺血再灌注損傷模型的血液樣本進行代謝組學,發現花生四烯酸通路代謝物12-HETE在不同物種中均敏感響應心臟缺血再灌注刺激。進一步研究發現,12-HETE上游脂氧合酶ALOX12在再灌注後的心臟中顯著上調,明顯加重再灌注引起的心功能下降、心肌壞死、心肌重構以及心衰。
該研究的分子機制研究首次提出,ALOX12可直接靶向NEDD4-TAK1抑制AMPK訊號通路,該作用不依賴於其產生12-HETE的酶活性。值得注意的是,該研究首次發現ALOX12小分子抑制劑ML355可有效改善小鼠、巴馬豬和恆河猴等多物種的心臟缺血再灌注損傷、心臟功能下降和心肌重構。李紅良團隊的研究成果為深入探索心臟缺血再灌注損傷的關鍵機制、改善心梗患者血運重建預後、提高患者生存率提供了有力支撐。
“過去十幾年,團隊在解析重大心血管和代謝性疾病的根本發病機制、篩選調控疾病程序的關鍵靶點、開發靶向治療的先導化合物方向進行了系統研究,構建了臨床研究、基礎研究、轉化與先導藥物開發等研究體系。”李紅良告訴《中國科學報》。
他指出,團隊系列研究發現疾病關鍵調控因子180餘個、臨床樣本驗證潛在治療靶點 40餘個、大動物模型驗證靶點10餘個。上述研究成果發表在國際期刊上共計 200 餘篇。
系列研究成果為後續心血管和代謝性疾病的新藥開發及臨床前研究奠定了重要基礎。
此外,李紅良團隊前期研究成果證實ALOX12-12-HETE-GPR31軸顯著促進缺血再灌注導致的肝臟損傷,使用 ALOX12 小分子抑制劑可有效緩解肝臟損傷並提高肝功能(Nat Med. 2018;24:73-83)。該研究工作是上述系列工作的延續,進一步闡明瞭心肌缺血再灌注損傷的核心驅動因子,揭示了ALOX12在心臟缺血再灌注損傷的功能與作用機制,為提高心梗患者PCI預後提供了新的治療靶點與策略。