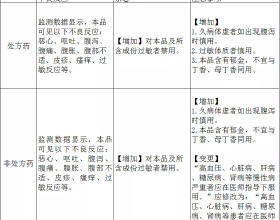
2021年10月12日,國家藥監局釋出關於修訂藥品說明書的公告(2021年第117號)。根據藥品不良反應評估結果,為進一步保障公眾用藥安全,國家藥品監督管理局決定對抗病毒糖漿、膠囊、軟膠囊、丸(濃縮丸)、滴丸、片、泡騰片、咀嚼片、口服液、顆粒說明書【不良反應】、【禁忌】和【注意事項】項進行統一修訂。各持有人應於2021年12月27日前報省級藥品監督管理部門備案。
藥品說明書是藥品生產企業提供的包含藥品有效性、安全性以及正確使用方法的具有法律效力的技術性檔案,是醫師、藥師、患者選用藥品的法定依據。透過修訂說明書,可以對安全用藥相關資訊進行補充、更新及規範,實現對用藥風險因素進行有效的控制,達到防範或減輕用藥風效、提高臨床用藥安全性的目的。
本次對多箇中藥劑型的藥品說明書進行修訂,代表藥品質量監管邁向新臺階。
對藥品說明書安全用藥相關資訊進行修訂,需要做好藥品不良反應監測,對上市藥品的不良反應監測是確保藥品安全的一道重要關口。以前我國藥品說明書存在內容不規範,“不良反應”、“禁忌”等安全性資訊缺乏,更新速度遲滯等嚴重威脅公眾健康的問題,是因為尚未建立成熟的管理體系,沒有實行全生命週期管理模式,許多企業在不良反應資訊收集和反饋上做的不夠好,沒有自主開展對說明書安全性資訊進行補充修訂。
隨著新《藥品管理法》出臺,藥品上市許可持有人應當開展藥品上市後不良反應監測,主動收集、跟蹤分析疑似藥品不良反應資訊,對已識別風險的藥品及時採取風險控制措施。
那企業怎麼透過自主開展不良反應監測活動來對藥品說明書進行補充修訂呢?
CIO合規保證組織是國內第一家提供醫藥全生命週期第三方服務的專業機構,有數十位藥品領域專家,深入研讀法律法規,為多家藥企提供藥品不良反應諮詢和建立藥物警戒體系等合規服務。
藥企應建立不良反應監測體系,建立相應的組織機構,指定專(兼)職人員負責本企業藥品不良反應報告和監測工作。建立藥品不良反應報告制度,建立ADR報告收集、呈報、處理程式,建立突發、嚴重藥害事件應急機制。
只有透過不良反應監測和藥品上市後再評價,才能促使那些質量不穩定、缺乏同一性,功能不確定、缺乏有效性,不良反應嚴重、缺乏安全性的藥品不斷完善,把那些具有嚴重安全隱患的藥品淘汰出局,實現藥品的安全性與有效性的高度統一。