隨著非洲豬瘟病毒潛伏期的延長和致病力的減弱,對異常豬核酸檢測的效率在下降,需要結合抗體檢測在引種監測、正常豬群監測預警甚至定點清除等多個環節中提供決策依據。但在抗體檢測時頻頻出現假陽性,這讓決策者左右為難。本文根據現場表象、試劑盒原理及抗體動力學規律等就假陽性產生的原因和辨別假陽性的措施進行經驗分享,希望有助於獸醫科學決策。
一、假陽性常常出現的場景和現象
(1)血液樣本在出現溶血、膠凍狀或存在敗血症時容易出現假陽性,其檢測的抗體數值大多為可疑或剛突破陰陽性判定閾值。
(2)抗凝血樣本分離血漿後用於檢測抗體可能易出現假陽性(注:臨床中存在採用抗凝血進行抗原和抗體雙檢測的實踐。即採集的抗凝血離心,血細胞用於核酸檢測,其檢測核酸的敏感性確實會升高;將抗凝血分離的血漿進行抗體檢測,雖然這可避免二次採集全血的麻煩,但這種血漿在檢測抗體時容易出現假陽性)。
(3)檢測用的洗滌用非去離子水,檢測時出現假陽性。
(4)有些樣本的檢測數值往往是剛剛超出陰陽性判定線,但間隔幾天後重複取樣複測後抗體檢測的數值不再上升或判定結果又為陰性。
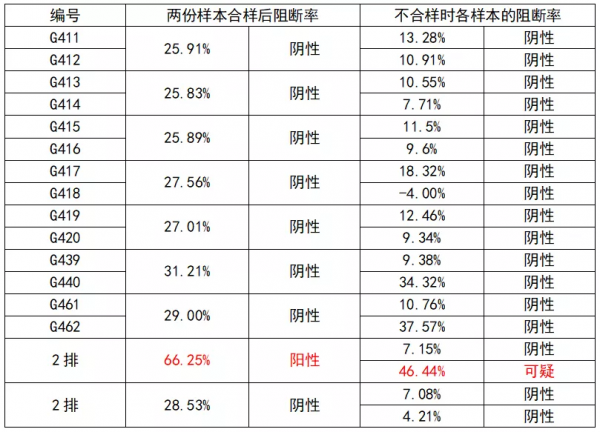
(5)將兩份以上的血清樣本合樣後進行檢測,合樣後其檢測數值升高,合樣後的樣品結果為陽性,但分別檢測單個樣本,每個樣品抗體判定又是陰性。
表1 兩份樣本合樣後的樣本和分別檢測每個樣本時抗體數值
二、假陽性出現的原因解析
假陽性可能有以下三方面原因
(1)核酸檢測方法多針對的是個體定性,而抗體檢測方法多針對的是群體檢測的資料分析。在特異性這個指標上,核酸檢測試劑往往比抗體檢測試劑的標準更高。
(2)在非洲豬瘟抗體檢測中阻斷法或競爭法比間接法更易出現假陽性(注:從其他檢測試劑的資料反饋和原理上,間接法應該比競爭法更易出現非特異性反應。但在試劑檢測工作中,非洲豬瘟抗體檢測中競爭法的假陽性比例更高。但我們不能以這個指標就去簡單用於判定試劑盒的優劣,其假陽性發生率應該與試劑盒陰陽性閾值的標準、樣本中的干擾因素有關,這需要對檢測資料進行統計分析,得到實驗室經驗的預警值,下文中將會作展示和闡述)。原因可能是阻斷法往往是針對單個抗原表位,該表位一旦被封閉,阻礙了該表位與最終顯色的酶標一抗的結合,由於阻斷法或競爭法是酶標一抗結合越少,判斷其抗體效價越高(見圖1原理解析),因此容易產生假陽性。表位被非特異性結合可能出現在以下原因中:
圖1 競爭ELISA(或透過計算公式為阻斷法)抗體檢測原理圖
①血清學檢測配液和洗滌必須用超純水。較差的水質帶有雜質或者某些離子會導致螯合反應,繼而有可能影響二抗的結合。
②抗凝管中肝素抗凝,分離的血漿會增加OD值,可能與高濃度肝素具有強大的負電荷,能吸附酶標記物不易洗脫有關。
溶血、血樣呈膠凍狀,可能產生螯合反應(也可能就是一種非特異性結合)封閉其抗原表位,進而影響了二抗的結合。
③樣本合樣後導致的假陽性可能是一種凝集反應。打一個不恰當的比喻,我們都知道不同血清型的人輸血有可能出現嚴重的凝集反應,單個血清中其pH值,和蛋白之間的結合是一個穩態;但當合樣後,兩種或多種血清之間會發生蛋白間的相互作用或化學反應,形成螯合物有可能覆蓋了表位,導致部分二抗無法結合,接近臨界值就成為假陽性。
(3)試劑盒的檢測敏感性與假陽性的矛盾可能是很難調和的。我們都知道國外是將非洲豬瘟抗體檢測試劑用於區域淨化的,這就要求更高的敏感性,為了提高敏感性將判定閾值線(cutoff)降低就可能是其中的選項之一。與之類似的是偽狂犬病gE抗體檢測試劑,當把陰陽性閾值線調低了之後,會增加假陽性的機率,這也是下文的解決方案中需要做資料分析的原因。
三、不同場景下試劑盒的選擇
實驗室根據不同場景和不同目的,準備不同的抗體檢測試劑盒進行檢測和監測。
(1)引種監測(場內還存在生產群)時,因隔離時間短,需要更為敏感的試劑盒,才能在剛感染時及時發現,避免路途中感染的風險。
(2)陰性場或大環境壓力較小的規模場,需要用敏感性中等的試劑盒作定期監測,避免因誤診,增加一線人員的工作強度。
(3)發生問題的豬場,在部分清群后,需要用更敏感的檢測試劑盒進行監測。
四、如何鑑別假陽性或假陰性
一個假陽性的出現可能會導致豬場進入戰時狀態,進而打亂豬場的生產節律,會給陰性場造成不必要的巨大損失,因此實驗室和獸醫團隊在上報異常樣本時,需同時開始複檢。可透過以下措施降低假陽性或避免假陰性。
(1)實驗室需要對樣本的狀態進行登記,對溶血和膠凍狀的樣本進行特別備註,一旦這些樣本檢出陽性,就需要懷疑是否是樣本狀態出現了問題。
(2)外界環境壓力比較大時,儘量不要進行樣本混合。
(3)複檢:針對少量樣本的檢測結果為剛過陰陽性判定線,但所有呈陽性的樣本的檢測數值普遍較低時,這種情況下則極有可能出現了假陽性。其他疫病在疫病暴發初期(如藍耳)的正常樣本的檢測數值是符合正態分佈的,既有高抗體的(感染時間很長了),也有低抗體(剛剛感染的)。非洲豬瘟的p72蛋白免疫原性非常好,其正態分佈會很窄,因此在真實的野毒(主要是指弱毒,強毒可能在抗體產生之前已經出現異常而被發現)感染過程中有可能檢測結果都是高抗體值的,較少會發現剛剛轉陽的個體。非洲豬瘟感染抗體動力學顯示,感染後抗體可能在感染後20天即可以達到峰值,因此在臨床上很難在剛剛感染時即監測到低抗體數值的樣本。
針對上述可疑或弱陽性的樣本,有兩種方法可用於複檢:
①用另一種試劑盒複檢。實驗室應該準備兩種以上的不同抗體檢測試劑,正常比例8:2,如配三種可以是7:2:1。配置的不同試劑盒應採用不同的檢測方法。
②重新取樣,對可疑豬進行隔離,2~3天后重新取樣,如果是真陽性抗體數值可能會升高,如果是假陽性復採檢測結果有可能轉陰性(若複檢還是弱陽性,可以淘汰該豬,並監測周邊豬群,如周邊豬群轉陽,緊急將整棟或整條線的豬淘汰處理)。
(4)要對檢測資料進行分析,關注接近於陰陽性判斷閾值的數值。
分析資料時不能僅看結果判定的陰陽,還需對數值進行統計分析,找到實驗室的預警數值。對比不同檢測試劑盒的檢測資料,會發現有些樣本在剛剛轉陽時,使用不同試劑盒的結果判定雖然不同,但是有一定的平行關係。
表2 針對感染場的檢測資料分析
該豬場為持續感染場,藍色底紋內的資料是首次檢測到陽性的樣本,其他陽性樣本為間隔7天檢測到的陽性樣本。由上表2資料可見,感染的豬隻抗體數值會非常高(藍色底紋內的資料)。第一種檢測試劑盒很敏感,因此M13-M17號(與首次爆點臨近的豬隻)樣本可能剛被感染即檢測為弱陽性,對相同樣本用第二種檢測試劑盒檢測,雖判斷為陰性,但對錶中綠色底紋的資料(試劑盒1判定為陽性,試劑盒2判定為陰性)和橙色底紋內資料(正常判定為陰性的樣品資料),真陰性數值<0.1,而M13-M17號樣本數值有平行升高。綠色底紋內06和07號樣本第四種檢測試劑盒檢測為陽性,1號檢測試劑盒檢測為陰性,但第一種、第二種、第三種檢測試劑盒的檢測抗體水平都有明顯升高的現象。
因此實驗室不能僅以閾值判斷陰陽性,需特別關注檢測資料並進行統計分析,找到更能指導臨床應用場景的經驗閾值或預警數值,避免假陽性和假陰性的判斷的失誤。
專家點評
隨著非洲豬瘟疫情在我國的發展,病毒呈現一定的多樣化,弱毒株感染佔比在上升。弱毒株潛伏感染能力強,感染臨床症狀不明顯,病毒載量低。透過臨床手段很難早發現,單純地開展熒光PCR檢測也不足以早發現和及時清除感染。豬場除了開展熒光PCR檢測病原,需要結合抗體監測,減少病原漏檢。
檢測結果的準確率對獸醫決策至關重要。多方面因素會導致抗體檢測出現的假陽性,需要從以下幾個方面入手,從取樣質量、實驗室檢測環境、檢測人員培訓、檢測耗材等方面保證檢測的標準化規範性;另外需要不斷提高實驗室的評價能力,包括提高檢測人員的資料分析能力、對檢測試劑盒的評價等等。
文章對非洲豬瘟抗體檢測假陽性問題進行了詳細的分析,就不同應用場景選擇對應試劑盒提出了建議;描述了可能的假陽性結果以便我們分析。
學習該文章可以幫助實驗室與一線獸醫協同,綜合分析資料與臨床表現,不斷修正在監測預警和疫病流行規律上的檢測指標,從而讓試劑盒適用於不同的應用場景,讓監測融入生產環節,發揮最大的價值。