*僅供醫學專業人士閱讀參考
ADC聯合療法有望為肺癌患者帶來新希望!
抗體藥物偶聯物(antibody-drug conjugate,ADC)是一類透過特定的連線頭將靶標特異性的單克隆抗體與高殺傷性的細胞毒性藥物偶聯起來的靶向生物藥劑,以單克隆抗體為載體將小分子細胞毒性藥物以靶向方式高效地運輸至目標腫瘤細胞中[1]。
ADC藥物的概念最初源自100年前Paul Ehrlich提出的“魔術子彈”概念,但直至20世紀80年代,才隨著非免疫原性(尤其是人源化)單克隆抗體的研發而出現飛速進展。ADC藥物結合了靶向性、選擇性強的抗體和高抗腫瘤活性細胞毒性藥物的優勢,在保留小分子細胞毒性藥物腫瘤殺傷特性的同時,選擇性降低小分子細胞毒性藥物的脫靶副作用,有效提高了抗腫瘤治療的獲益風險比。因此,近年來ADC藥物一直是腫瘤精準治療領域的熱門研究方向之一[1]。
肺癌作為全球發病率和死亡率均最高的癌種,研究學者從未停止對其治療的探索。除了靶向治療和免疫治療,肺癌相關的ADC治療也越來越多。既往研究顯示,ADC藥物治療難治性非小細胞肺癌(NSCLC)患者具有一定的療效,客觀緩解率(ORR)達20.3%~39%[2-3]。然而,ADC藥物治療NSCLC仍存在諸多挑戰,譬如治療過程中可能出現毒副作用、暫無理想的預測生物標誌物、現階段對ADC藥物的耐藥性機制瞭解不充分,以及如何尋找合理的ADC聯合治療策略等。其中,合理的ADC聯合治療策略一直是科學家們探尋的方向。
什麼是合理的ADC聯合治療策略?
合理的ADC聯合策略能夠增加ADC活性[4],可能透過以下4種形式實現:
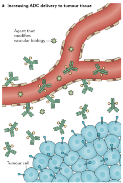
1.增加ADC向腫瘤組織的輸送:
抗血管生成藥物,如靶向VEGF訊號通路的藥物,可能透過促進腫瘤血管正常化來改善ADC向腫瘤組織的輸送,或增強ADC的細胞毒性作用(圖1a)。
2.調節抗體靶蛋白表達和/或過程:增加腫瘤細胞表面靶抗原表達的藥物可能會促進抗體抗原的結合。
另外,增強抗原轉換或降解的藥物可能會促進ADC的攝取和有效載荷的切割和釋放,從而增強細胞毒性(圖1b)。
3.增強有效載荷活動和/或合成殺傷力:
透過互補機制或合成殺傷力發揮協同作用的其他藥物可增強有效載荷活動(圖1c)。
4.促進抗腫瘤免疫:
免疫療法有潛力建立在ADCs誘導的抗腫瘤免疫上,可以透過增強抗體依賴的細胞細胞毒性或透過增強細胞介導的腫瘤識別和免疫效應功能(圖1d)。
近年來,ADC聯合治療NSCLC有哪些新進展?
01 ADC與抗血管生成藥物聯合研究正在進行中
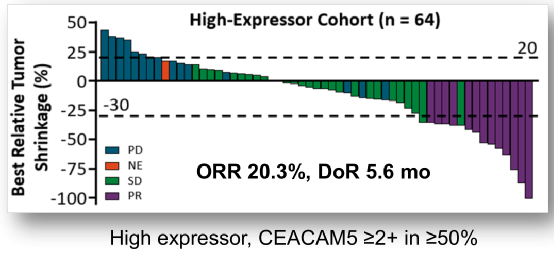
SAR408701是一種靶向癌胚抗原相關細胞黏附分子5(CEACAM5)的DM4結合型ADC,在2020年ASCO年會上,SAR408701治療非鱗狀NSCLC的劑量擴充套件佇列研究(NCT02187848)結果顯示[5],SAR408701在之前已接受過多線治療的CEACAM5高表達的晚期非鱗狀NSCLC患者中具有良好的抗腫瘤活性。
資料截止2020年1月,研究共入組了92例患者,包括28例CEACAM5中度表達(1%~49%)和64例CEACAM5高表達(≥50%)患者。對主要終點ORR進行分析,在CEACAM5高表達患者中,ORR達20.3%(13例實現部分緩解)(圖2)。
基於SAR408701在既往接受過多線治療的、CEACAM5高表達的晚期非鱗狀NSCLC患者中表現出的有希望的抗腫瘤活性,SAR408701聯合雷莫西尤單抗聯合治療既往經治的非鱗NSCLC的II期研究正在進行中(表1)。
表1. NCT04394624研究
為了確定奈拉替尼和T-DM1聯合治療引起的受體內化增強是否可以增強抗腫瘤療效,該臨床前研究採用奈拉替尼、T-DM1或聯合治療伴ERBB2擴增和突變(S310F)的相同肺人源腫瘤異種移植模型(PDXs)。結果顯示,雖然T-DM1和T-DM1與奈拉替尼聯合均可誘導顯著的腫瘤消退,但聯合治療的效果更持久(儘管用奈拉替尼單藥治療觀察到的活性可以忽略)[6](圖3)。
另一項研究與上述臨床前資料一致,該研究中納入的1例發生肺轉移的41歲ERBB2擴增乳腺癌患者在接受多種抗HER2治療後復發(包括T-DM1)。在T-DM1進展後,立即將奈拉替尼加入到T-DM1中,該患者在治療6周後出現活躍的部分反應(-38%)[6](圖4)。
03 ADC與免疫檢查點抑制劑(ICI)之間存在潛在的協同作用
研究顯示,Trastuzumab Deruxtecan(T-Dxd)可增強同基因小鼠模型的抗腫瘤免疫功能[7-8]:
1.上調樹突狀細胞(DCs)上的CD86
2.增加腫瘤浸潤DCs/CD8+ T細胞
3.上調程式性死亡配體1(PD-L1)表達
4.與程式性死亡配體(PD-1)單抗具有抗腫瘤協同作用
一項單臂、多中心試驗,共納入54例既往經治的轉移性非小細胞肺癌患者,在21天為一週期的第1和8天接受8或10mg/kg sacituzumab govitecan(IMMU-132)(一種靶向SN-38的Trop-2 ADC)。在響應評估研究人群(n = 47)中,ORR為19%;平均響應時間為6個月(95% CI,4.8-8.3個月);意向治療(ITT)人群的中位無進展生存期為5.2個月(95% CI,3.2-7.1個月),ITT人群的中位總生存期為9.5個月(95% CI,5.9-16.7個月)(圖6)[9]。

圖6. sacituzumab govitecan治療既往經治NSCLC研究結果
基於該研究結果,阿替利珠單抗聯合的Ib/II期、開放標籤、多中心、隨機雨傘研究正在進行中(圖7)[10]。
目前多項ADC聯合治療研究正在進行中(表2)[11],未來,期待有更多的ADC聯合方案用於NSCLC患者臨床治療,希望ADC聯合治療方案早日成為肺癌患者的治療新選擇。
表2.進行中的ADC聯合治療研究
[1].抗體藥物偶聯物治療惡性腫瘤臨床應用專家共識(2020版)[J]. 中華腫瘤雜誌,2021,01:78-91.
[2].Nakagawa. WCLC 2020; Jänne PA. ASCO 2021.
[3].Camidge DR. AACR 2021; GazzahA. ASCO 2020.
[4]. Joshua Z Drago, Shanu Modi, Sarat Chandarlapaty. Unlocking the potential of antibody-drug conjugates for cancer therapy.Nat Rev Clin Oncol. 2021 Jun;18(6)327-344
[5]. Gazzah A,Ricordel C,Cousin S,et al.Efficacy and safety of the antibody-drug conjugate(ADC) SAR408701 in patients(pts) with non-squamous non-small cell lung cancer(NSQ NSCLC) expressing carcinoembryonic antigen-related cell adhesion molecule 5(CEACAM5) [EB/OL].J Clin Oncol 38:2020(suppl;Abstr 9505).
[6]. Bob T Li, Flavia Michelini, Sandra Misale et al. HER2-Mediated Internalization of Cytotoxic Agents in ERBB2 Amplified or Mutant Lung Cancers.Cancer Discov. 2020 May;10(5)674-687.
[7]. Nakayama T. Mol Cancer Ther 2018
[8]. Gajewski TF. Nature Immunol 2013
[9]. Heist RS, Guarino MJ,et al.Therapy of Advanced Non-Small-Cell Lung Cancer With an SN-38-Anti-Trop-2 Drug Conjugate, Sacituzumab Govitecan.J Clin Oncol. 2017 May 26
[10].https://www.clinicaltrials.gov/ct2/show/NCT03337698?term=Morpheus-Lung&draw=2&rank=1
[11]. ClinicalTrials.gov
*此文僅用於向醫學人士提供科學資訊,不代表本平臺觀點