對映選擇性合成銨離子
文章出處:Mark P. Walsh, Joseph M. Phelps, Marc E. Lennon, Dmitry S. Yufit, Matthew O. Kitching. Enantioselective synthesis of ammonium cations. Nature 2021, 597, 70-76.
摘要:分子手性的控制是有機合成中的一個基本挑戰。近年來,對映選擇性構建碳立體中心的方法已經建立,而富集雜原子立體中心的合成途徑卻很少受到關注。在有機分子中普遍存在的原子中,氮是最難用立體化學方法控制的。雖然有限數量的拆分方法已經被證明有效,但沒有通用的方法用於對映選擇性製備氮立體中心。在本文中,作者發現,透過超分子識別過程很容易控制銨離子的手性結構。作者透過將1,1’-聯-2-萘酚(BINOL)核骨架介導的對映選擇性銨離子識別與允許氮立體中心外消旋化的條件相結合,可獲得高產率和高對映選擇性的手性銨離子。機理研究表明,透過溶液和固相識別的結合,一個熱力學驅動的加合結晶過程導致了高的對映選擇性。不同於基於動態和動力學解析度的動力學過程,該熱力學過程允許增加選擇性隨時間的自我校正過程。氮立體中心的重要性可以透過立體選擇性超分子識別來揭示,而自然存在的假對映體金雞納生物鹼不可能實現該識別過程。隨著作者對銨離子對映體的實際應用,這個以前被忽視的立體中心現在可以進行進一步探索。
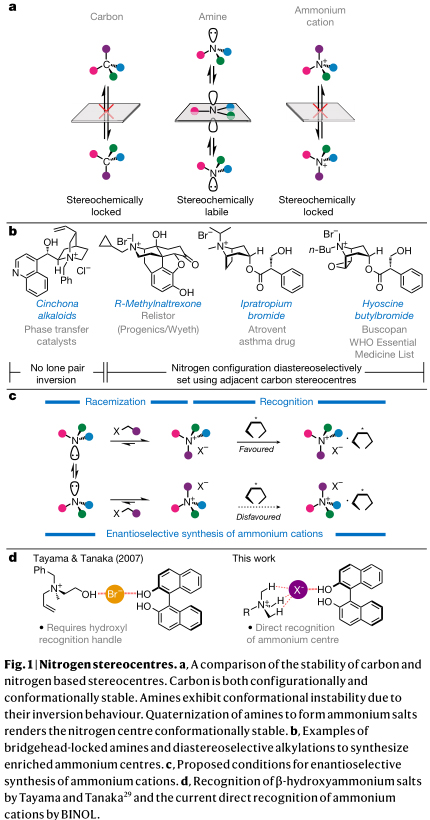
立體氮中心對映選擇性製備的困難源於其構象的不穩定性。碳立體中心在構象和構型上是被鎖定(圖1a)。相比之下,叔胺中氮原子的立體性往往被忽視,因為該中心通常透過量子隧道使氮孤對電子發生反轉而快速完成構象轉換。形成銨離子的季銨化阻止了這種倒轉並鎖定了氮立體中心的結構。在兩種體系下成功地合成了氨立體中心。當阻止氮的孤對電子反轉時,就會產生具有特定構型的手性銨離子,如剛性雙環金雞納生物鹼(圖1b)。另外,氮的構型是透過對映異構選擇方式將立體化學資訊從碳骨架轉移到銨中心來確定的,如藥物合成中的溴化甲基納曲酮、定喘樂和解痙靈(圖1b)。然而,以上系統的構象剛性和鄰近立體中心的影響,阻止了氮差位異構體的直接製備。事實證明,要獲得氮是唯一立體元素的化合物具有挑戰性。如果可以減緩(例如N-氯嗪啶、惡嗪啶和吡嗪啶)或阻止(例如Tröger的鹼基的罕見情況)氮的轉化,則可以合成和分離含有立體氮中心的化合物。自1899年首次分離出對映體富集的銨離子以來,只有少數基於動力學拆分和自發拆分的方法可以分離出對映體富集的銨離子。到目前為止,還沒有對映選擇性合成銨離子的方法。
作者推斷,陽離子銨的對映選擇性合成需要滿足三個條件(圖1c)。首先,需要一個通用的識別過程,以區分銨立體中心的兩種對映體形式。其次,氮立體中心的結構必須是暫時動態的,允許兩種對映體形式的相互轉換。透過將銨離子置於烷基化可逆的條件下,銨中心可以脫烷基,提供構象不穩定的銨。在這種狀態下,氮中心的轉化是快速的,非選擇性的再烷基化導致銨立體中心的外消旋化。第三,在識別和外消旋相容的條件下,透過結合這兩個過程,季銨鹽對映體的穩定傾向將導致銨物種的熱力學驅動的動態拆分。
為了區分銨離子的對映體形式,作者檢測了其與眾所周知的手性物種1,1’-聯-2-萘酚(BINOL)的相互作用。對映純烷基化的天然產物(例如金雞納生物鹼)在BINOL拆分中的使用已得到很好的證實。然而,逆向過程即使用對映體富集的BINOL識別銨中心卻很少受到關注,儘管它被用作其它的拆分策略中。Tayama已發表的文章中已經透過結構上模仿金雞納生物鹼證明了銨中心的動力學拆分過程。當一個銨離子帶有一個羥基官能團,在強氫鍵的介導下,銨離子、電荷平衡離子和BINOL之間形成三元絡合(圖1d)。已知四烷基銨中心表現為分佈的陽離子,具有類似於醇的氫鍵供體能力(N +C-H··X的氫鍵供體引數α = 2.7),作者假設氫鍵直接與銨離子本身成鍵是可能的。
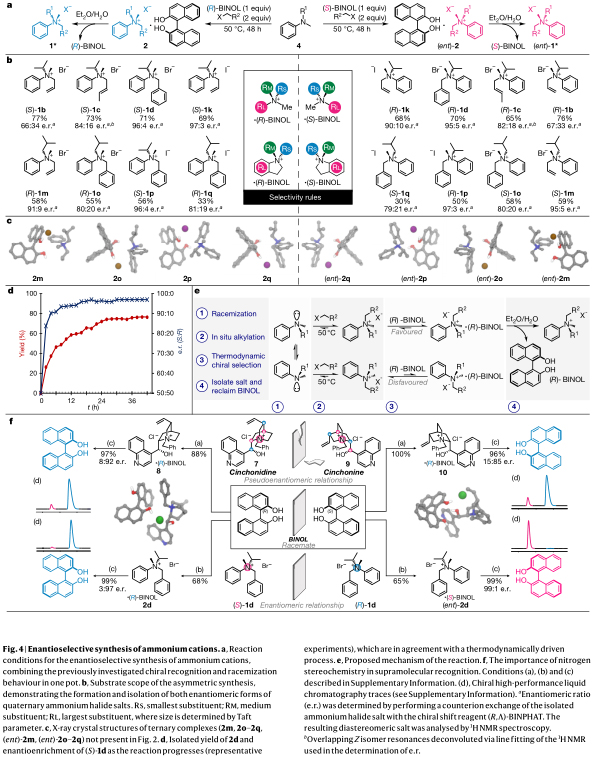
初步的研究表明,BINOL·X−·銨絡合物的形成使銨鹽離子無需額外的識別手段就能被拆分(圖2)。對常用的BINOL衍生物和其它識別物的篩選結果表明,簡單的非功能化BINOL是該過程中最優的識別物。在濃度高(0.6 M)的條件下,向外消旋的銨1化合物中加入(R)-BINOL(0.5倍當量),迅速生成對映體富集的三元配合物2(圖2a)。採用NMR手性位移試劑(R,Λ)-BINPHAT形成對映體鹽3,透過1H NMR分析對映體富集的三元配合物2的富集進行定量分析。每個樣品的絕對構型透過X射線衍射確定。對這一過程的確定提供了三個關鍵的觀察結果(圖2b)。首先,氮上取代基之間足夠的空間體積差異被證明是實現高選擇性的必要條件。例如,高產率形成的絡合物2a的乙基取代銨的識別效能很差(圖2b,第2a行,59:41 d. r.)。相比之下,BINOL介導的異丙基銨的識別具有更高的選擇性(圖2b,第2b行,82:18 d.r.)。其次,這種富集水平可以透過再結晶來提高。化合物1c的絡合最初產生了絡合物2c (80:20 d.r.),單次重結晶增強了2cʹ的富集水平(90:10 d.r.)。第三,不同種的苯基銨(2a-2d,2f,2k,2l),吲哚啉基銨(2e,2g-2i)和苄基銨(2j)同常見的烷基化試劑如烷基(2l)、烯丙基(2a,2b,2e,2f,2k),巴豆基(2c,2g),苯基(2d,2i)和炔丙基(2h,2j)鹵化物反應,能以高的產率(基於0.5倍當量BINOL的產率為53-89%,基於1倍當量銨離子的產率為26-44%)得到良好的識別效能,其富集水平從中等(2f,57:43 d.r.)到優秀(2l,99:1 d.r.)。這個過程透過使用BINOL的對映體,能同樣容易地識別出銨離子的對映體形式(圖2b,(ent)-2a-(ent)-2l),具有相似的產率和對映選擇性。
實驗結果表明,該識別機制既有固相成分,也有溶液相成分。在氘帶氯仿的樣品1b中加入(R)-BINOL (0.5倍當量)後,1H NMR譜中可以觀察到明顯的位移(圖2c)。直接圍繞銨中心的脂肪族質子環境的共振訊號(圖2c(II),質子訊號a-g)顯示了多重性增加的和可觀的上場位移,這與溶液中BINOL與鹵化銨結合形成兩種對映體配合物的混合物相一致。為了探討BINOL物種氫鍵貢獻作用的重要性,作者合成了單甲基化和雙甲基化的變體。當使用雙甲基化物種進行識別時,1H NMR未觀察到溶液態識別,且溶液保持均勻。單甲基化物種,有一個自由氫鍵供體,表現出與弱溶液態結合有關的化學位移的輕微擾動。然而,這些對映配合物仍然留在溶液中,因為形成核並且提取所需的連續氫鍵網格被破壞。這突出了BINOL核骨架中存在的兩個氫鍵供體在識別和分離對映體配合物中的結構重要性。
為了瞭解這些對映體配合物之間的區別,它們是獨立製備的。首先,外消旋銨化合物1b與(R)-BINOL (2b)反應得到的配合物被重結晶為更富集的對映體,透過萃取去除BINOL,提供匹配的(S)-1b·(R)-BINOL配合物(圖2d)。然後將回收的富集對映體銨(S)-1b與(S)-BINOL絡合,生成不利的對映體(S)-1b·(S)-BINOL (不匹配對映體)。
對這些對映體的晶體結構分析得到了有趣的結果(圖2d,匹配對;圖2e,不匹配對)。由於不匹配對具有兩個獨立的銨陽離子構象(圖2e,陽離子和陽離子II),不對稱單元中匹配(分子數在不對稱單位Z’ = 1)和不匹配(Z’ = 2)對的明顯不同被觀察到。不匹配陽離子I (d = 2.451 Å,θ = 156.79°,其中d為原子間距離,θ為鍵角)和陽離子II (d = 2.347 Å,θ = 147.97°)中均存在緊密的C-H···O接觸。相反,在配對的銨離子的α-碳中心有C-H···Br接觸(C-H···Br,d = 3.224 Å,θ = 144.51°,d = 3.253 Å,θ = 159.58°)。兩種晶體結構中所有接觸點的相對重要性是很難解釋的。因此,它們在一個三維空間內被全面展示,並被描繪為Hirshfeld指紋圖。在這裡,可以直觀地識別晶體內部接觸的趨勢,匹配和不匹配結構之間最明顯的區別是不匹配對的陽離子I和II中存在C-H···O接觸(圖2e,紅色痕跡)。此外,更分散的Hirshfeld圖表明,與匹配結構的銨更緊湊的圖相比,不匹配結構的銨的圖不夠緊湊。熔點(m.p.)分析也表明匹配結構(m.p. = 150-152 oC)比不匹配結構(m.p. = 137-139 oC)具有更大的穩定性。結合能計算結果也證明匹配結構(E = -215.7 kJ·mol-1)比不匹配結構(E = -197.6 kJ·mol-1)更穩定。這種穩定性似乎源於匹配結構的三元配合物(堆積密度ρ = 1.343 g·cm-3)比不匹配的三元配合物(ρ = 1.328 g·cm-3)堆積更有效。這些結果與透過形成BINOL·X-·銨三元絡合物對銨離子的液相識別一致,隨後作為成核中心,允許其透過加合結晶選擇性地抽離到固相。
接下來,作者試圖建立氮立體中心外消旋化的條件。對Lehn條件的修改表明,1b (圖3a (I))在稀釋濃度下加熱時完全解離,提供苯胺4和溴化烯丙基5 (圖3a (II))。在較高的濃度下,平衡位置偏向於銨鹽。當化合物4和5在50 oC加熱時(圖3a (III)),化合物4和1b的平衡比例由1H NMR確定為相等 (圖3a (IV),4:1b,50:50)。為了直接觀察銨的立體化學完整性,將富集的(R)-1d樣品與過量的(8倍當量)溴化苄基6溶解在乙腈(0.4 M)中並加熱。光活度的衰減速率分析表明,立體化學資訊在準一級動力學下損失(圖3b (I),半衰期t1/2 = 56.5 min,λ = 0.012),在425分鐘後無法測量光活度。(S)-1d表現出相同的行為(圖3b (III))。這些結果與SN2過程是一致的。這些測量終點的1H NMR結果表明,大量的銨留在溶液中,證實了旋光性的損失是由於氮立體中心的外消旋作用而不是簡單的離解作用(圖3b (II, IV))。
這些動態條件結合作者的識別過程允許一步法對映選擇性地合成銨立體中心(圖4a)。在這裡,苯胺4、烷基化劑(2倍當量)和(R)-BINOL (1倍當量)在濃縮條件下(0.6-2.5 M)結合,並在50 oC下攪拌48小時,生成白色固體三元配合物2。令人滿意的是,溴離子和碘離子與前體苯胺直接生成的一系列烯丙基化、丙基化和苄基化手性銨配合物介導了這一過程。每個新銨離子的絕對構型都在晶體結構上得到了證實(圖4c中化合物2m,2o-2q,(ent)-2m,(ent)-2o-2q)。為了產生立體化學資訊僅存在於氮立體中心的材料,對富集的鹵化銨進行了分離。用乙醚和水進行簡單萃取,得到了收率極高的季銨鹽滷化物(圖4b中化合物1b-1d,1k,1m,1o,1p;63-99%的收率;總收率30-77%)和再生的BINOL(收率62-98%)。使用(S)-BINOL可以獲得具有相當產率和對映選擇性的互補對映體(圖4b中化合物(ent)-1b-1d,(ent)-1k,(ent)-1m,(ent)-1o,(ent)-1p)。
對照實驗證明了關鍵的引數是必不可少的過程。平衡烷基化劑的溫度、濃度和當量,使銨立體中心進行動態交換,同時允許相容的識別發生。對這些反應的溶液相組成分析表明,殘留在溶液中的未絡合銨也偏向於(S)對映體。以上結果證明了固相和溶液相銨離子具有相同的富集意義,為立體銨中心的對映選擇性合成提供了明確的證據。
隨著時間的推移,反應的進展分析給出了自我糾正過程的證據(圖4d)。在化合物2d製備的時間過程分析中,複合物的產率在最初的12小時內迅速增加,在26小時後緩慢攀升至75%。對映體富集的化合物(S)-1d,配合物2d的銨組分也觀察到類似的增加:在大約16小時後,從初始值(t = 2 h, 84:16 e.r.)到最終平衡值(97:3 e.r.)。這樣的結果與基於動力學拆分的過程形成了鮮明的對比,在動力學拆分的過程中,隨著反應的進行,選擇性預計會降低。這個“錯誤檢查”的功能為該反應是熱力學驅動的過程提供了進一步的證據。
基於空間位阻的考慮,可以初步提出一種與迄今為止所獲得的結果相關的選擇性模型。當最大的基團與最小的基團共面時,無論是透過自由旋轉還是透過環的存在鎖定,當使用(R)-BINOL時,第二大基團將佔據近端位置(圖4b)。
考慮到上述觀察結果,作者認為這種一鍋法過程如圖4e所示。構象不穩定的銨可以進行可逆的、非選擇性的烷基化,形成外消旋的銨離子和初始銨的平衡混合物。隨著鹵化銨的出現,BINOL絡合可以從溶液中選擇首選的對映體,形成富集的三元絡合物。不匹配的三元配合物的形成也會發生,導致銨離子初始的適度對映體富集。然而,考慮到不匹配結構的相對不穩定性,該複合物優先溶解,從固相中釋放出不利的鹵化銨。在溶液中的鹵化銨可以進行外消旋化,並以首選匹配形式重新絡合BINOL,導致隨著反應的進行富集水平增加。
為明確證明手性銨離子在沒有BINOL的情況下的立體化學穩定性,對每個對映體進行了反離子交換,提供了結晶的六氟磷酸鹽1t。對映體鹽在P41和P43的對映體空間基團內結晶,其構型與在各自的三元配合物中觀察到的構型一致。對(R) (Flack = -0.05[7])和(S) (Flack = 0.07[5])形式的Flack引數的分析證實,每個晶體都具有高水平的對映體富集。當暴露在同該立體中心外消旋溴鹽同樣的條件下,這些六氟磷酸鹽的構型穩定性被進一步證明。在50 oC下用乙腈加熱1t溶液24小時不會導致樣品光學活性的相應損失。這些結果表明,這種氮立體中心的動態行為可以透過保留所引入的立體化學結構來阻止。
為了證明氮立體中心的重要性,作者研究了金雞納生物鹼的主要應用,即其在對映選擇性超分子識別中的有效性。這種識別能力是它們作為分解劑的催化能力和熟練程度的關鍵。辛可寧和辛可尼定之間的假對映體關係經常被用來實現對映體選擇性轉化,其誘導意義相反。BINOL與烷基化的金雞納生物鹼的兩種偽對映體形式的超分子識別提供了富集於(R)-BINOL的三元配合物(圖4f中化合物8和10),一旦釋放,可觀察到在高對映體富集 (對於化合物8,92:8 e.r.,R:S;對於化合物10,85:15 e.r.,R:S)。相比而言,當作者使用銨立體中心的純對映體形式時,可以實現BINOL的超分子識別,(R)-1d與(S)-BINOL形成複合物(圖4f中化合物2d,> 1:99 e.r.),其對映體(S)-1d提供(R)-BINOL (圖4f中化合物(ent)-2d,97:3 e.r.),具有極佳的選擇性,超過了金雞納的同類產品。鑑於金雞納生物鹼和金雞納啶在氮上具有相同的構型,這些結果與立體氮在金雞納生物鹼超分子識別中發揮基礎性作用的結果相一致。這些觀察結果提供了一個新的機會來質問銨立體中心在所有使用四烷基化銨陽離子的學科中的作用。
總之,作者描述了一個操作簡單的對映選擇性合成季銨鹽陽離子。此外,控制氮的立體化學的重要性已經透過使用目前合成的富銨陽離子對BINOL的兩種對映體的超分子識別得到了證明,這一過程無法透過自然發生的金雞納衍生的假對映體實現。隨著穩定的氮立體中心的獲得,作者希望這一經常被忽視的立體中心的重要性將在依賴四烷基化銨陽離子的領域得到進一步探索。