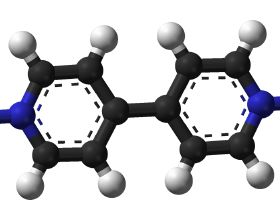
飽和雜環的光介導環收縮反應
文章出處:Justin Jurczyk, Michaelyn C. Lux, Donovon Adpressa, Sojung F. Kim, Yu-hong Lam, Charles S. Yeung, Richmond Sarpong. Photomediated ring contraction of saturated heterocycles. Science 2021, 373, 1004-1012.
摘要:飽和雜環化合物在許多醫療和生物活性天然產物中都有發現,在許多藥用和農用化合物庫中也有豐富的分佈。為了獲得新的化學空間和功能,目前已經發展了許多方法對這些結構的外圍進行功能化。相對而言,很少有方法能夠重構其核心框架。在這篇文章中,作者描述了一種可見光介導的α-醯化飽和雜環的環收縮反應。這種非常規的轉變與傳統的環收縮互補,挑戰了雜環多樣化的正規化,包括哌啶、嗎啡啉、噻烷、四氫吡喃和四氫異喹啉衍生物。Norrish II型變種的成功依賴於在特定的化學環境中光反應性酮基團之間的反應性差異。這一策略被應用於藥物衍生物、多肽和糖的後期重塑。
飽和雜環化合物,尤其是哌啶類化合物,是生物活性小分子中最常見的核骨架。哌啶類核骨架在藥物和農用化合物庫中廣泛應用。為獲得新的化學空間,科學家對哌啶類化合物的位點進行選擇性衍生化的開發越來越感興趣(圖1A)。C(sp3)-H功能化的最新進展為哌啶類核骨架的外圍功能化提供了許多強有力的方法,改變了晚期功能化的正規化。相比之下,哌啶類核骨架的修飾方法較少,這促使科學家尋求用於這一目的的方法。這種方法對於藥物發現尤其有價值,在藥物發現中,最大限度地增加結構多樣性,特別是在後期階段,是非常有價值的。為此,作者尋求開發一種哌啶和相關飽和雜環碳環框架的環收縮方法,以實現核骨架修飾,而不是外圍修飾。
與碳環的環收縮方法相比,哌啶類化合物的環收縮方法相對較少。例如,僅在環己酮衍生物中,陰離子、碳烯和陽離子中間體都被用來實現環收縮。相反,對於飽和含氮雜環(氮雜環),常用的環收縮策略主要利用雙環、季銨中間體,這些中間體在受到外源性親核試劑進攻時可以進行環收縮(圖1B)。最近,作者報道了一種透過氧化C(sp3)-N鍵裂解來收縮哌啶環的方法:首先Ag介導N-苯甲醯吡咯烷的溴化分解,然後是C-N鍵的分子內重組,形成環溴胺,分兩步提供相應的N-苯甲醯吡咯烷核骨架(圖1B)。儘管有用,這些策略僅限於哌啶到吡咯烷核骨架的轉換,需要特定的取代模式,並使用強氧化性條件,對後期的多樣化修飾構成挑戰。不飽和氮雜環系統如吡啶和二氫吡啶的光介導環收縮方法也已被探索,然而這種環收縮的方法僅適用於具有公認的光反應特性的底物。
作者試圖開發一種互補的、結構上獨特的方法來收縮哌啶環,這種方法也可以應用於廣泛的飽和雜環,以用於未充分開發的、核骨架多樣化的底物。作者從Seebach已發表的文章中報道的一個不尋常的轉變中獲得靈感(圖1C),其中α-羧基四氫異喹啉(THIQ)衍生物(1a)在強鹼性條件下收縮到相應的吲哚核骨架(2a)。這種轉變的特點是內環的N原子轉移至外環,產生了一個β-氨基酸結構基序。儘管這種轉化方法很新穎,但目前只報道了兩個例子,而且所需要的強鹼性條件限制了該方法在含鹼性反應官能團的類藥物分子骨架修飾中的應用。Suárez已發表的文章中報道了一種功能基團更相容(儘管類似特異)的這種型別轉化的變體,可以得到α-二酮基衍生糖。該轉化經歷光介導的環收縮,隨後透過半酮基化形成融合的[5,5]環系統(2b) (圖1D)。值得注意的是,反應所需的α-二酮部分在生成的產物中發生了衍生化。作者設計了互補環收縮方法,尋求廣泛的官能團相容性和更大的範圍(超出了α-二酮基衍生糖)。在這裡,作者報道了可見光介導的醯基化環哌啶的收縮,以提供順式1,2-二取代環戊烷核骨架(圖1e),並將這種方法擴充套件到其他飽和雜環,包括四氫吡喃和硫烷。這些Norrish II型轉化的成功取決於預測(和觀察到的)起始底物和產物中酮基團之間的光物理差異,同時描述了這種轉化的非對稱變體。
圖1
作者的研究從關注哌啶環的環收縮開始(圖2A)。作者設想,在光照後,α-醯化前體,如I,其芳香基以偽軸向配置以避免偽A1,3-型應變時,將會發生激發和系統間交叉以獲得三重態II。隨後的Norrish II型1,5-氫原子轉移(HAT)將產生相應的1,4-二自由基(III),後者將發生均溶性C-N鍵斷裂。然後,分子內烯醇攻擊被束縛的亞胺(Mannich反應)生成所需的環戊烷產品。然而,在光照下,作者也意識到潛在的副反應(圖2B),特別是進一步反應產物(V)形成額外的激發物質如VI。
原則上,反應成功與否取決於起始原料(I)和反應產物(V,一種預期的“光固定”狀態),因為兩者都含有一種光反應苯基酮,這種苯基酮可能參與Norrish型過程(見VI)。在Suárez已報道的文章中(圖1D),產品中的α-二酮在半酮化過程中達到了光固定狀態,這使得反應得以順利進行。作者設想,即使在本文的反應條件下,光反應部分的化學轉化不會在產物形成時實現,但I和V的n→π*光吸收譜的差異可能會由於V中建立的分子內氫鍵而產生。眾所周知,空間上禁止的n→π*轉變,在區域性環境中增加的極性會導致λmax的藍移,作者預計這將導致I和V的光反應性的差異。此外,作者意識到其它光化學過程可以勝過作者想要的環收縮反應。例如,Norrish I型C-C鍵從三重激發態(即II)的均裂可能導致不需要的烷基-醯基自由基對的形成(VII),這一情況在二烷基酮中更為突出。另一個可能的併發副反應是在1、5位的氫原子被抽離後出現的,其中雙遊離基的III發生自由基重組,產生相應的[3.1.1]-雙環化合物(VIII),即Norrish-Yang環化反應。作者認為,III的Norrish II型的C-N斷裂反應(最終生成V)抑制了Norrish-Yang環化反應,因為環丁醇C-C鍵形成所需的單線態二自由基的體系間交叉速度較慢。這能阻止氮芥醇VIII的環閉合反應,抑制不利構象的形成,
本文中,儘管存在著苯基酮底物發生副反應及深度反應的風險,然而基於化合物I和V預期光吸收率的差異,作者推斷,調節光的波長可以選擇性地促進所需的反應,同時最小化所產生的產物的光反應性。令人滿意的是,在室溫及400 nm藍色LED燈照射下,化合物3a能以73%的產率轉化為1,2-二取代環戊烷4a (圖2C,第1行)。實驗結果顯示,在400 nm波長的光照射下,光介導的環收縮反應的效果最好。較長波長的光照射下(如以450 nm為中心且能量較低)不會發生任何反應;而較短的波長的光照射下(如以385 nm為中心且能量較高)時,這與計算和測量的產物和原料的吸收曲線更接近,導致競爭的非特異性齊聚。哌啶氮上的磺醯基能以高的產率促進所需產物的生成,可能是增強了化合物4a分子內的氫鍵,這說明了其在反應條件下的穩定性。哌啶氮上的其它吸電子基團,如苯甲醯基、叔丁氧羰基(Boc)或吡戊醯基(圖2C,第2至4行),會降低環收縮產物的產率。溶劑的選擇也很關鍵。苯可增強化合物4a的氫鍵,因此苯為溶劑時的產率和非對映選擇性最高。其它溶劑,如甲醇(圖2C,第5行)、乙腈(圖2C,第6行)、甲苯(圖2C,第7行)和三氟甲苯(圖2C,第8行)則會導致產量和非對映選擇性的降低。考慮到使用苯的毒性問題,作者將對二甲苯作為苯的替代溶劑(圖2C,第9行)。降低底物的濃度也能提高產率,0.05 M的底物濃度被認為是最優底物濃度,該濃度會減緩分子間副反應的反應速度。透過以上的實驗嘗試,作者確定了哌啶磺醯衍生物的最最佳化反應條件,該條件下4a的產率為84%,且具有高的對映選擇性(圖2C,第13行)。在連續(流動)條件下,反應可以放大至克級(圖2C,第14行)。含有其他保護基團如醯胺和氨基甲酸酯底物,反應產率會降低。這一現象是有趣的,因為表面上看,起始底物中的光反應苯基酮基團是保守的。作者假設,改變氮上的基團(如磺醯或氨甲醯)會導致苯基酮的三重態能的離散差異。作者假設光敏劑或光催化劑可以提高反應的效率,因此使用醯胺底物3n來比較46種已知光敏劑和光催化劑的效能。3-氰基-7-羥基香豆素(IX,圖2C,第16行)作為新增劑,可有效提高反應的效率:哌啶底物3m,3o,3s和3t以平均提高11%的產率轉化為相應的環戊烷。以上觀察到的結果比較微妙且依賴底物,瞭解3-氰基-7-羥基香豆素(IX)作用的工作目前正在進行中。
圖2
在最最佳化的反應條件下,作者探索了可見光介導的環收縮反應的底物範圍(圖3A),首先研究了氮原子上基團的通用性。具有吸電子取代基的芳基磺醯基哌啶類衍生物,如酮類(3h)、酯類(3i)和鹵素類(3e至3g),能以中等或良好的產率生成相應的環收縮產物。同樣,具有供電子基團的芳基磺醯基的哌啶類化合物,如醚(3c和3d),也能進行環收縮反應。對硝基取代基(3j)的存在會引發光淬滅,導致環收縮反應不能發生。儘管哌啶氮上的芳基磺醯取代基導致了最高的環收縮產物產率,但在3-氰基-7-羥基香豆素(IX)存在時,哌啶氮上帶有的醯基(3m到3p)、氨甲醯(3q)和尿素型基團(3r和3s)的底物也成功進行了環收縮反應(圖3A)。
含磷酸醯亞胺的底物(3t和3u)也很有效,其環戊烷產物的產率可與含磺醯基底物的產率相媲美。在這些情況下,磷醯胺基在酸性條件下很容易被除去。新增劑的效果也會隨著底物的不同而變化,新增IX後,底物3q到4q的反應產率受到的影響最小。因初始底物的非生產性構象而導致生產性氫原子轉移的減少,最終導致產率的持續降低。
接下來,基於α-芳基的性質,作者探究環收縮反應的範圍(圖3B)。結果表明,該反應對空間結構非常敏感,對甲基取代的底物(5a)比異構的甲基取代底物(5b)具有更高的產率和對映選擇性。具有供電子取代基的芳基酮,如醚(5c)和硫醚(5d),對期望的產物具有良好的產率和對映選擇性。含鹵素的α-芳基酮(5e)在環收縮反應中也很有效,為環收縮後的進一步修飾提供了額外的功能位點。透過比較,p-CN和p-CF3等吸電子基團的底物(5f和5g)產率中等,對映選擇性較低,這可能是由於產物中α-酮-質子酸性增加導致異構化的結果。作者的理論計算結果表明,逆向的Mannich-Mannich反應途徑的超異構化是不可能的。另外,作者觀察到底物5g的產物透過Norrish II型反應開環,證明了在某些情況下環戊烷產物的潛在深度反應活性。其它芳香酮也進行了驗證。例如,延伸至芳烴體系如萘基酮(5h),以及雜芳烴體系如噻吩基酮(5k)。雖然只對α-芳基底物的反應條件進行了最佳化,但幾種含非芳基的取代酮也能在相同的條件下參與環的收縮轉化反應。值得注意的是,炔基C(sp)底物(5l)和乙烯基C(sp2)底物(5m)都可以得到所需的環收縮產物。5l底物的產率大幅下降的原因是競爭性的Norrish-Yang環化反應生成了氮芥醇副產物。在光照強度更強的高壓汞燈照射下,烷基C(sp3)取代的酮5n轉化為環收縮產物6n的產率僅為25%。雖然反應的光照強度增大了,但反應的主導因素仍然是始材料和產品中酮基團的差異反應性。
之後作者對取代哌啶和其它幾個飽和雜環進行了環收縮反應底物範圍的探究(圖3C)。γ位的單取代基底物(7a)可形成立體對照。苯並環化底物如四氫異喹啉(7b)成功地進行了環收縮反應,在溫和的條件下提供了相應的氨基茚核骨架(8b)。此外,含有嗎啡啉核骨架的底物在光照下轉化為四氫呋喃雜環(8c)。環收縮方法也從氮雜環框架擴充套件到了α-醯化的硫烷和四氫吡喃衍生物。這些底物可形成環戊烷硫醇和醇類產物(8d至8h)。底物7d光照條件下生成的硫醇(8d)可看作是共價修飾劑。
圖3
最後,作者擬將環收縮方法應用在生物活性小分子上,以展示該方法對候選藥物後期衍生化的潛力。光照下,MDMC (9a,興奮劑),利米特羅(9b,支氣管擴張劑),卡西酮(9c,DAT再攝取抑制劑)和甲氟喹(9d,抗瘧藥)的衍生物透過環收縮反應都能生成相應的環戊烷異構體(圖4A)。底物9d的產物中存在著一個開環的醛副產物,可能是由於亞胺中間體在Mannich型環閉合反應之前發生水解。作者認為可能是底物9d中缺電子的雙三氟甲基喹啉基團導致的水解開環。環收縮方法也肽多樣化中也能發揮作用(圖4B)。在這裡,含甘氨酸的肽11底物被轉化為相應的氨基環戊烷(12),可作為一個氫鍵供體。光照條件下,α肽組轉化為相應的β-氨基酮,完成了肽的修飾。作者準備在未來的工作中揭示光照條件下肽轉化的機制。
由於環醚衍生物參與了這些光介導的環收縮反應,作者也探究了糖編輯中的這種重排(圖4C)。在400 nm光照條件下,D-半乳糖衍生的雙丙酮底物13得到同分異構體開環產物14。在這裡,Norrish II型開環反應產生的烯醇可能會互變異構為芳基酮,而不與內酯羰基結合,為糖衍生物提供強大的靶向“消化”作用。
圖4
為了深入瞭解光介導的環收縮反應的立體選擇性的機理,作者對N-對甲苯磺醯基哌啶衍生物3b的反應進行了理論計算的研究(圖5A)。所有的量子化學計算在Gaussian 16程式中使用過渡態模型。理論計算採用SMD模型,選用M06-2X/6-31+G**基組,苯作為反應溶劑,進行相應的幾何最佳化和頻率計算。作者最初假設1,5-HAT的位置選擇性可能是由於α-氨基氫原子更大的水合性和更低的鍵離解能(圖5A,33B→3A)。利用密度泛函理論(DFT)計算,作者發現氫化和極性匹配度更高的哌啶基氫原子的HAT躍遷態能量比γ位置的C-H的能量低9.0 kcal·mol-1。計算還揭示了N-S鍵在過渡態的構象偏好,其中羰基和磺基氧之間保持了最大的分離。
作者還推斷了順式排列的氨基環戊烷(4b)的對映選擇性可能是由Mannich型環閉合過渡態的π-堆疊和氫鍵等一系列非共價相互作用引起的。計算的過渡態結果證明了Mannich型環化/C-C鍵的形成與質子從烯醇部分轉移到N-對甲苯磺醯基團一致,與Suárez已發表的文章中對己糖碳水化合物中醛類環化的推斷一致。圖5C的三種設想,從定性上支援實驗觀察到的對映選擇性結果。在第一種情況下,只有(E/Z)亞胺烯醇能產生。當二自由基中間體3a的斷裂速度快於醯基鍵的旋轉時(圖5a中3A橙色鍵),這種幾何形狀就出現了。另外,如果烯醇(C=C)和亞胺(C=N)鍵的(Z)和(E)形式的相互轉換是容易的,那麼所有四種可能的亞胺-烯醇雙鍵構型都可以在Mannich環化反應中得到。然而,得到(Z)-亞胺(Ts軸)所需三聯體的1,4-二基構象需要很高的能量,(Z)-亞胺的幾何結構對立體化學結果的貢獻預計是可以忽略不計的。因此,作者認為最可能的情況是,二自由基的壽命足夠長,允許醯基鍵旋轉和隨後的兩個烯醇對映異構體的生成。在這種情況下,只有(E/Z)和(E/E)亞胺烯醇是可獲得的,TS-1-4之間的能量差異將決定立體化學結果。這四種過渡態的玻爾茲曼平均值預測了順式環戊烷異構體14:1的比例,與實驗確定的12:1的比例很好地一致。其順式對映選擇性主要來源於TS-3和TS-4之間的能量差異,這可能是由於TS-3的氫鍵較短且強,以及C-C鍵形成過程中取代基的交錯排列(圖5C,1B→14b)。N-對甲苯磺醯基哌啶底物3b向兩種環戊烷產物的總體轉化是放熱的(4b的能量為-4.2 kcal·mol-1,而4b的反式異構體的能量為-3.3 kcal·mol-1)。
DFT計算結果和化合物3b和4b吸收曲線的經驗測量結果深入解析了反應條件下起始材料與產物的選擇性的差異。儘管起始物質和產物的計算的λmax值(圖5B)沒有顯著差異,但作者觀察到與預期的n→π*相關的出現在300到375 nm的二次吸收峰(圖5B)。在這裡,相對於起始的哌啶底物3b,觀察到氨基環戊烷產物4b的低色移可能是由於起始物質的選擇性激發。經驗測量結果也顯示對產物的吸收率整體下降(如3b的ε340 = 48.0 L·cm-1·mol-1,而4b的ε320 = 19.2 L·cm-1·mol-1)。雖然光化學過程的預測和合理化傾向於集中在λmax值上,但在作者的系統中,λmax光照會導致原料和產物的無選擇性地反應。透過聚焦在300到375 nm的次級n→π*吸收區域,作者能夠透過利用吸光度波長和消光係數的細微差異來調節酮基的反應性,酮基結構在起始物質和產物中都可以保留。400 nm光源的發射光譜與起始材料吸收的光波長略有重疊,但與產物的重疊很小。然而,根據經驗確定的商用的400 nm藍色LED光源仍然與測量的吸收值完全一致。
圖5
作者對觀察到的這些反應的對映選擇性的見解,主要來自於作者的理論計算結果得到的非手性亞胺-烯醇中間體的高度組織過渡態,結合對映選擇性光介導環收縮反應的成功發生,啟發作者去研究對映選擇性的變體。作者觀察了對映體富集的底物3b在環收縮條件下的外消旋產物4b的形成,證實了在這種形式的自由基極性交叉中,亞胺-烯醇中間體是非手性的。因此,作者準備透過影響非手性亞胺-烯醇中間體在雙電子反應過程的對映選擇性來避免與自由基中間體立體控制相關的固有挑戰。鑑於大量的手性磷酸催化亞胺反應的文獻先例和預測模型,作者假設在亞胺質子化和烯醇去質子化後,Mannich反應步驟的速率會增加,有利於有組織的過渡態進攻一個對映異構體。這種情況將實現的氫鍵和離子配對的結合,預計將產生對映體富集的Mannich產物(圖6)。
與這一假設相一致的是,以10 mol% (R)-TRIP (CPA1)作為新增劑的底物3b的環收縮得到了產物(-)-4b,對映體比為92:8 (e.r.),對映選擇性為84%,其產率和對映體選擇性與形成外消旋體的標準反應條件一致,使用SPINOL衍生的磷酸(R)-XYL-SPA (CPA2)作為新增劑可得到產物(+)-4b,對映體比為95:5 (e.r.),對映選擇性為90%。醯胺、尿素、THIQ、嗎啡啉和四氫吡喃衍生物,也能以適中的對映選擇性產生對映體富集的產物4m、4s、8b、8c、8e和8g。
圖6
透過Norrish II型反應,作者構建了一種用於哌啶類和其他飽和雜環核骨架重建的通用方法。整個反應過程是富有活力的,適用於廣泛的官能團。反應成功的關鍵是透過分子內氫鍵對產物中的酮基進行“光保護”,作者的實驗和理論計算結果支援了這一推斷。同時,手性磷酸使該反應具有對映選擇性。