基於病毒載體的基因療法成為許多先天性和獲得性疾病最先進的治療方法之一,具有代表性的病毒載體包括腺病毒相關載體(Adeno-associated viral vectors, AAV)和慢病毒載體(Lentiviral vectors, LVV)。隨著 7 款以病毒載體為基礎的基因療法獲得批准,全球範圍內,有接近 1000 個以美國和中國為首的臨床試驗正在進行。
市場對於病毒載體的需求呈爆發式增長。在國內,CRO/CDMO 公司和元生物從 2018 年至 2020 年,營業收入從 4420.97 萬元上升至 14276.91 萬元,年均複合增長 79.70%。CDMO 公司派真生物則憑藉著 AAV 的生產,已服務 200 + 家海內外知名基因治療藥企及科研院校,服務範圍遍佈 15 個國家地區。
然而,業內依舊公認:病毒載體的大規模生產仍面臨典型的挑戰,包括可擴充套件性、量產、整體缺乏穩定性等。
近日,美國約翰斯霍普金斯大學材料系及生物醫學工程系教授、奈米生物技術研究所副所長毛海泉博士在 Nano Letters 上發文表示,開發了一種提高慢病毒載體大規模生產效率和可靠性的奈米技術,稱提高了病毒載體生產的可靠性、重複性以及產量。
目前,毛海泉團隊就該技術和藍鳥建立合作,將共同開發下一代大規模奈米轉染技術,雙方已經在進行臨床規模的放大實驗和生產流程最佳化。
對此,生輝也聯絡到了毛海泉及本文第一作者胡一宗博士,就這項研究進行了探討。
大規模生產、尺寸可控
以研發為目的的小規模慢病毒載體生產多采用生長在培養皿、培養瓶、多盤系統(Cell Factories, Cell Stacks)的貼壁細胞。由質粒 DNA (pDNA) 和聚乙烯亞胺(PEI)組裝的複合顆粒已被廣泛用於生產基因治療的慢病毒載體 。但當轉向臨床實驗時,則需要大量的慢病毒載體,生產工藝放大就極為重要。
其核心步驟之一是使用質粒 DNA 轉染在生物反應器內大規模培養的細胞,讓它們作為 “工廠” 在細胞內生產病毒載體的各個部分,隨後進一步組裝、純化。
“此步驟不僅需要繁瑣的溶液準備和混合過程,還涉及嚴格的操作時間控制,在工藝重複性和可靠性上有顯著侷限,不便於放大生產;同時,業界對於決定轉染步驟效率的因素缺乏認知,導致病毒載體的產能提升緩慢,且普遍缺乏產量對投料量的遞增相關性。這樣的生產工藝滿足目前的臨床需求已經初現緊張,且無形中提高了成本,勢必限制病毒載體基因治療領域在未來的長遠發展。” 胡一宗說道。
儘管 pDNA/PEI 奈米顆粒已經被廣泛用於轉染各種型別的細胞,但現有的方式組裝的顆粒大小為 30-200nm,幾乎沒有報道過顆粒直徑超過 200nm 的顆粒的轉染活性。
基於此,該研究團隊設計了一種可擴充套件的方法,透過顆粒表面電荷的可逆調整,透過自下而上的組裝策略生產 60 到 1000 nm 之間任意尺寸的 pDNA/PEI 顆粒。

圖 | pDNA/PEI 顆粒的大小決定了它們在慢病毒載體生產細胞中的轉染效率(來源:上述論文)
根據胡一宗的介紹,團隊從先前該體系的動力學組裝原理的研究結論出發,首先判斷 400-500nm 大小的奈米顆粒可能需要上千條 DNA 進行組裝,從而否定了透過一步法直接合成的可能性。
然後,基於對該體系動力學穩定性的理解,團隊研究者開發了一種自底向上的方法,即首先合成尺寸在 50 奈米左右的、由單個 DNA 組成的、由表面互斥電性穩定的 DNA-PEI 奈米顆粒作為單元物,接著透過提高溶液鹼性和增加離子強度降低互斥電荷密度,從而可控地操縱單元物相互融合。當尺寸生長至目標區域時將溶液條件逆轉,奈米顆粒重新在該尺寸由表面互斥電性穩定。
“我們的研究表明 pDNA/PEI 顆粒的大小是高轉染效率的關鍵決定因素,最佳大小為 400-500 nm。這也是由細胞攝取相關機制所決定。這種顆粒製造方法有效地簡化了病毒製造過程,提高了生產質量和一致性。”
儘管 pDNA/PEI 複合奈米顆粒不是新型材料,很多公司都用來生產病毒載體。但胡一宗直言,仍舊存在無法使奈米顆粒穩定的問題,這些公司也並不清楚是什麼性質決定轉染和生產效率。“我們發現了納米顆粒的尺寸是決定性因素,並且可以做到大規模生產尺寸控制的、高效的顆粒。”
“通用性高,無產業化限制”
事實上,毛海泉團隊和藍鳥淵源已久。兩年前在美國基因和細胞治療協會的年會上,胡一宗展示了相關的研究,藍鳥生物資深科學家 Nolan D. Sutherland 與之聯絡,並討論了該技術及其在慢病毒載體生產中的應用。Sutherland 認為該團隊的方法可能有助於簡化轉染,這是生產病毒載體的關鍵步驟。
在本次研究的後續驗證中,團隊將奈米顆粒在實驗室生產後冷凍,經低溫運送至藍鳥公司,直接在反應器內進行慢病毒載體生產試驗。
結果表明,這些奈米顆粒在低溫下可以儲存至少 4 個月而保持穩定;融化後的奈米顆粒完全保留了其生產尺寸和濃度,且可在數小時內在室溫下保持穩定。這使生產流程不再需要嚴格的投藥時間控制,極大地簡化了生產操作。同時,在中試規模的反應器內,這些穩定的奈米顆粒相較於該公司標準生產流程的最佳對照,提高了慢病毒載體的產量。
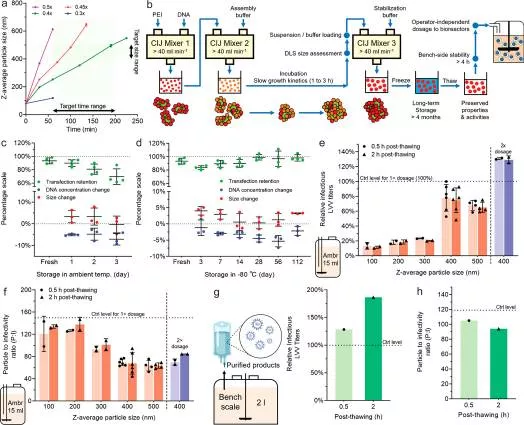
圖 | 控制大小的 pDNA/PEI 顆粒的放大生產,並驗證生物反應器中 LVV 生產的轉染效率(來源:上述論文)
對於該結果,Sutherland 也十分欣賞,“隨著對基於慢病毒載體的細胞治療產品的需求急劇增加…… 這項新技術將大大提高我們治療性 LVV 的生產質量、一致性和產量。” 目前,雙方已經在進行臨床規模的放大實驗和生產流程最佳化。
提及該技術產業化潛力時,毛海泉表示,“團隊特地選擇了一款通用的包裹核酸的材料,轉化可能性更高,也可以用於其它材料。且由於在試驗中已經放大到公升級了,對於大規模推向產業化基本無限制。"
胡一宗也補充道,“由於病毒載體生產是用於體外規模培養的細胞的,不存在安全性問題,DNA/PEI 轉染生物反應器內的細胞後,最終是把這些細胞全部裂解提純病毒載體,也不會殘留 PEI。”
面對業內普遍存在的病毒載體規模化量產的難題,毛海泉也表示,這項技術也可以考慮推廣給其它基因治療公司。並稱在瞭解國內轉讓立項的前提下,也會考慮創辦公司。
“產量翻倍,成本可降低 2 倍”
“病毒載體基因治療的主要挑戰之一是如何提高製造的病毒載體的質量、純度和成本,以便我們可以使用盡可能小的有效劑量,減少免疫副作用,並降低治療成本。” 毛海泉表示。
“如果產量可以翻倍,那麼成本就有可能降低 2 倍。”Catalent 細胞和基因治療業務部產品開發全球負責人 Thomas VanCott 博士表示, Catalent 是最早生產 AAV 載體的工廠之一,也是第一個獲得 FDA 許可的提供基因治療產品的 CDMO。
對於上述提到的可擴充套件性、穩定性和量產等問題,除了毛海泉團隊外,業內也有不同的見解。
對於基因治療,遞送載體一般為 AAV、腺病毒和慢病毒。如果要有效地生產,製造商們需要合適的細胞系。
“理想情況下,應該使用穩定的細胞系來最小化批次間的差異。但是,由於病毒基因在整合到細胞基因組中時具有一些固有的毒性,因此細胞系的產生和維持非常棘手。”Vigene Biosciences 首席商務官 Jeffrey Hung 博士說,該公司已經開發了哺乳動物和昆蟲細胞系,用於懸浮或貼壁培養中的病毒生產。
CDMO 公司 Thermo Fisher 對此也贊同,該公司已經開發了 CTS 病毒生產細胞 ,用於在懸浮 HEK293 細胞中生產可擴充套件的高滴度慢病毒。對於基因治療公司而言,以 Thermo Fisher 為代表的 CDMO 無疑是不二選擇,這類公司通常擁有工業規模基因治療工作流程的經驗,可以提供可靠高效的生產流程。
然而,國外能夠提供 AAV 病毒生產的 CDMO 公司,且能夠為處於 IND 階段較為成熟的專案提供完整服務的公司不超過 20 個。

圖 | Thermo Fisher Scientific 已開發出多種用於病毒生產的細胞系
除此之外,病毒載體生產過程最佳化也至關重要。上游科學家必須應對多種培養和轉染引數,而下游科學家必須應對缺乏適用於所有載體、血清型和表達系統的標準平臺。科學家們面臨著一些非常具體的挑戰,例如分離空的和完整的 AAV 衣殼,以及需要為每種血清型調整下游生物過程。
Sartorius 公司則在這方面擁有話語權,該公司有一個可以最佳化的平臺,可以快速純化所有 AAV 血清型,並實現有效的空 / 全衣殼分離。據悉,該平臺不依賴於 AAV 親和力測定,而是利用正交化學的組合來達到所需的純度和產量水平。
MilliporeSigma 則採取了一種綜合方法來滿足更高效病毒載體的生產需求,該公司建立了 VirusExpress 慢病毒生產平臺,它將高效能包裝細胞系與化學成分確定的培養基和最佳化的懸浮工藝相結合,以增強上游操作的可擴充套件性。據悉,該公司最近投資 1.21 億美元擴建了位於加利福尼亞州卡爾斯巴德的病毒載體制造 CDMO 設施,可容納 1000 升一次性生物反應器,將於年底上線。
病毒載體生產也需要經歷單細胞克隆階段。克隆性與製造過程中的一個階段有關,監管機構需要質量證據證明該過程已被簡化為單個細胞,以最大限度地減少細胞庫內的異質性以限制過程可變性。
Solentim 公司稱其技術可用於確保細胞系生產的克隆性,並提高細胞生長的效率。該公司使用者包括 GSK、Thermo Fisher 等。
可以看出,業內正在積極借鑑過去三十年生物製劑商業化的經驗教訓,不僅要面對載體生產的挑戰,而且還要提前考慮滿足商業規模和監管需求。