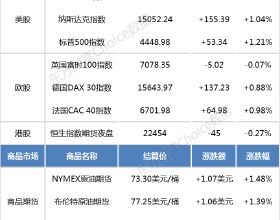
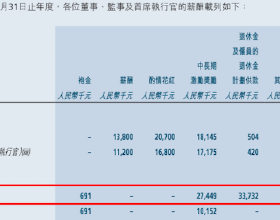
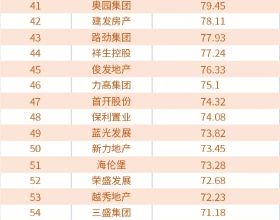
智通財經APP訊,創勝集團-B(06628)釋出公告,國家藥品監督管理局已受理其PD-L1/TGF-β雙重功能抗體TST005的試驗用新藥(IND)申請。公司已於2021年4月獲得美國食品藥品監督管理局(FDA)對 TST005的IND批准,且已於2021年7月的全球I期臨床試驗為首位美國患者給藥。
據悉,TST005為進入全球臨床試驗階段的第二個雙重功能抗PD-L1及TGF-β陷阱融合蛋白。其同時靶向兩個免疫抑制通路,即轉化生長因子-β (TGF-β)及程式性細胞死亡配體-1 (PD-L1),其通常被癌細胞用於逃逸免疫系統。TST005由高親和力 PD-L1抗體組成,在其C端與工程TGF-β受體II型蛋白融合。TST005缺乏FcR結合活性並因此減少FcR介導殺死的表達PD-L1效應T細胞。TST005的高PD-L1結合活性及增強的TGF-β陷阱穩定性可將TGF-β陷阱有針對性地遞送至表達PD-L1的腫瘤,從而將全身性抑制TGF-β訊號的脫靶毒性降至最低。TST005在逆轉TGF-β誘導的T細胞抑制中顯示出強大的體外活性。在多個同基因腫瘤模型中,TST005誘導CD8 T細胞向PD-L1表達的腫瘤中浸潤顯著增加並因其高TGF-β在對PD-(L)1療法不敏感的腫瘤模型中顯示出劑量依賴性腫瘤生長抑制。TST005在非人類靈長類動物中具有良好的耐受性,並顯示出線性PK特徵。TST005乃為具更佳醫療視窗的潛在差異化雙重功能候選免疫療法。
本文源自智通財經網