2021年10月12日,一項正在進行的I期、多中心、開放標籤臨床試驗CARBON的研究結果公佈,旨在評估同種異體CAR-T細胞療法CTX110在CD19陽性B細胞惡性腫瘤患者中的安全性和療效結果。
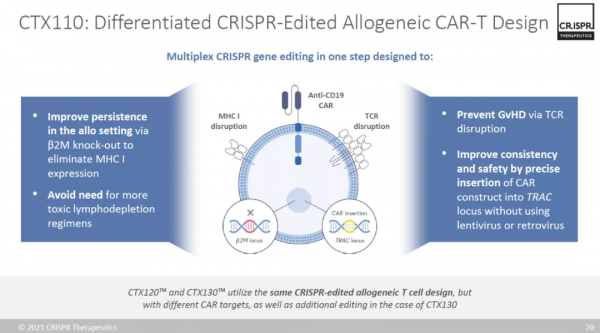
CTX110是一款利用CRISPR基因編輯技術製造的同種異體CAR-T細胞療法。它將靶向CD19抗原的嵌合抗原受體(CAR)定位敲入細胞的天然T細胞受體位點,在引入CAR的同時防止內源性TCR的表達,從而防止移植物抗宿主病(GvHD)的產生。
臨床資料
CARBON試驗是一項開放標籤、多中心臨床試驗,評估CTX110在復發或難治性的CD19陽性B細胞惡性腫瘤成人患者中的安全性和有效性,這些患者已接受過至少兩種先前的治療。
截至2021年8月26日,共納入30例大B細胞淋巴瘤(LBCL)患者入組,其中26例患者接受CTX110治療,隨訪至少28天,納入分析。只有1例入組患者未接受CTX110治療。3例患者在資料截止時的隨訪時間小於28天,無法用於本分析。
研究的主要終點包括透過劑量限制毒性(DLTs)發生率和客觀緩解率(ORR)。關鍵的次要終點包括完全緩解(CR)率、緩解持續時間(DOR)和總生存率(OS)。
DL2及以上患者的ORR和CR率均顯示在意向治療(ITT)和修改後的ITT(mITT)基礎上。ITT包括所有入組患者(DL2及以上,n=24),而mITT只包括接受CTX110輸注的患者(DL2及以上,n=23)。
試驗結果顯示,在接受DL2及以上單劑量CTX110治療的患者中,基於ITT的客觀緩解率(ORR)為58%,完全緩解率(CR)為38%;基於修改後的ITT(mITT)的ORR為61%,CR為39%。此外,在難治性疾病、巨大腫塊或既往自體幹細胞移植後進展的患者均有效。
在接受治療6個月後,CR率為21%,最長的緩解持續時間(DOR)超過18個月。這些資料表明,CTX110具有產生持久緩解的潛力。
安全性
CTX110在所有劑量水平均具有良好的耐受性,並沒有出現移植物抗宿主病,無輸注反應。
所有的細胞因子釋放綜合徵(CRS)均為1級或2級,或不需要特殊干預,或採用標準的CRS管理解決。在接受CTX110再次給藥的患者中,CRS的頻率和嚴重程度都沒有增加。
只有1例同時患有HHV-6腦炎的患者出現3級以上的免疫效應細胞相關神經毒性綜合徵(ICANS)。
只有2例患者經歷了3級或更高級別的感染:先前討論的 HHV-6 腦炎患者和一例出現假單胞菌敗血症並在四天內消退的患者。
結論
該試驗結果顯示,在大B細胞淋巴瘤患者中,較高劑量的CTX110單劑治療達到58%的客觀緩解率和38%的完全緩解率。這也表示同種異體CAR-T細胞療法CTX110在治療CD19陽性B細胞惡性腫瘤患者的I期臨床試驗中獲得積極安全性和療效結果。
【重要提示】本公號【全球好藥資訊】所有文章資訊僅供參考,具體治療謹遵醫囑!