來源:基因talks
前 言
基因的變異型別有多種(點選檢視),對應的分子檢測方法亦有多種,當前資本市場驅動著分子檢測市場,並極力追捧NGS技術,因為其通量高,靈敏度高且價效比高。小編承認NGS是分子檢測的必然發展趨勢,但是短時間內,NGS並不會取代其他分子檢測方法,因為針對不同的需求,都有對應的理想檢測方法,每個檢測平臺都有著自己的優勢,比如:
操作簡單:PCR,ARMS-PCR,HRM等
時間快速:ARMS-PCR,HRM等
成本低:PCR,PCR-RFLP,MassARRAY等
準確:Sanger等
通量高:NGS等
靈活性:Pyrosequencing等
結果分析簡單:ARMS-PCR等
自動化:核酸提取等
......
小編一直認為:沒有最好的技術,只有最合適的技術!最好的,不一定是最合適的;最合適的,才是真正最好的。
今天,我們聊一聊HRM技術,首先,我們先了解下什麼是HRM?
HRM:高解析度熔解曲線(High-resolution melting curve, HRM)。PCR擴增的融解曲線取決於其擴增序列,序列中一個鹼基的突變都可以導致雙鏈DNA的解鏈溫度發生變化,透過使用實時熒光定量PCR儀監測這種細微的溫度變化(但是這個差異極小,只有零點幾攝氏度,如果儀器的解析度不高,是根本無法檢測的),可以知道擴增的序列中是否有突變發生,從而對其進行基因分型。
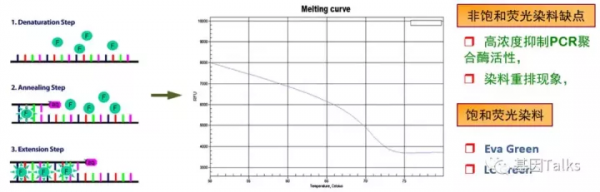
HRM實施的基礎是不同核酸分子物理性質的差異,透過實時跟蹤、收集升溫過程中飽和熒光染料與PCR產物結合的資訊,並進行軟體分析形成溶解曲線。溫度低時,染料結合牢固,熒光訊號強;升高溫度,DNA雙鏈解開,熒光染料隨之解離,熒光強度減弱。當溫度達到Tm值,50%的雙鏈DNA解成單鏈,熒光訊號強度達到最低。
HRM檢測原理
常規實時PCR使用的是不飽和SYBR Green染料,由於這種染料對PCR有抑制作用,所以使用濃度必須遠低於使DNA雙螺旋結構中小溝飽和的濃度。該技術難以保證染料與所有PCR產物結合,影響了檢測的解析度(不飽和染料在dsDNA解鏈時,熒光分子重新結合於未解鏈的dsDNA部位,熒光訊號沒有變化,不能反應樣品熔解溫度)。目前HRM使用的是一類與DNA結合能力更強和對PCR抑制作用更小的飽和染料(因為它們即便在飽和濃度(熒光最大)下,也不會抑制PCR),如Eva Green、LC Green、SYTO9等(飽和染料在dsDNA解鏈時,熒光分子同步脫落,訊號減弱)。因為飽和染料的使用,大大提高了HRM在單鹼基突變、小片段插入/缺失方面檢測的靈敏度和解析度。
HRM技術對實驗儀器的溫度解析度要求相當高,需要達到0.02~0.1℃,每升高1℃採集熒光25次,以滿足對單鹼基差異的區分。HRM對溫度均一性同樣要求較高,Tm的標準偏差為0.020-0.264℃(孔間溫度均一性要達到0.264℃以內才能保證HRM分析結果的準確性),一般PCR兩孔間溫差在0.3~0.5℃,這就導致兩孔間最終溶解溫度相差較大,無法保證HRM分析結果的準確性。(做HRM的話一般Roche的LightCycler 480可以考慮,公用熱室,可以保證單次PCR各反應管間溫度的均一性,而且有特殊的模組加熱技術及快速散熱裝置)
基因型一般有三種,野生純合,雜合,突變純合。首先變性,雙鏈解開,接著退火(假設60℃),此時引物結合模板,然後在Taq DNA聚合酶的作用下繼續延伸(假設72℃),此時所有的飽和熒光染料嵌和在雙鏈中,熒光訊號很強,接著再變性,此時的HRM監測的是72℃-95℃之間的溫度變化(直觀的就是熒光染料的訊號強度變化)。HRM得以區分單鹼基差異是建立在DNA鹼基本身的特性上的。G/C鹼基對由三個氫鍵連線,A/T鹼基對由兩個氫鍵連線,打斷三個氫鍵較打斷兩個氫鍵需要更高的能量,體現在G/C鹼基對具有更高的Tm值,也就是說多型性位點為G/C的雙鏈其熔解的發生較多型性位點為A/T雙鏈更晚(見下圖1)。比如上圖現在是T>C,那麼野生純合是藍色線,突變純合是紅色線,雜合是紅藍混合色(灰色),由於CC和TT是同源雙鏈,那麼CC跟TT型根據Tm很好區分,由於CT中會出現異緣雙鏈,這就會出現四種配對方式:AT,CG,GT,AC(見下圖2),其中AT,CG的混合使雜合型的熔解曲線表現為前兩種熔解曲線的整合形,而GT,AC的錯配雙鏈使它的熔解曲線更趨向低溫區,綜合以上使雜合型的熔解曲線與純合型的熔解曲線呈現交叉。(注:也可參考上篇ARMS方法設計引物,使用兩種不同的等位基因特異性正向引物,正向引物3'端的最後一個鹼基對應於SNP位點的二等位基因,反向引物都一樣,並使用熒光染料來檢測PCR產物。純合子基因組DNA只能被與其完全匹配的正向引物擴增,而雜合子基因組DNA能同時和兩種正向引物結合擴增出兩種PCR產物,這就可以很直觀的理解出四種配對的方式了)
圖1. G/C鹼基對比A/T鹼基對具有更高的Tm值
圖2. 雜合子溶解曲線由四種配對方式混合而成
結果解讀:允許在熔解相的前後進行充分的資料收集。在圍繞所觀察到的Tm值上下超過10°C(甚至更大)的溫度視窗內捕捉HRM資料值。這為有效進行曲線的標準化提供了足夠的基線資料值,可促進形成更為緊密的復性資料並且能夠更輕鬆地進行資料解釋。
HRM本質
HRM的資料分析是透過比較不同樣本之間熔解曲線的位置和形狀上的差異,來對基因型進行區分的。標準的HRM軟體包能夠將樣本熔解曲線的形狀和位置與對照進行比較。這一方法可能導致產生難以解釋的不可靠結果,因此有時可能必須要進行耗時的人工資料解釋。
當然,並不是每種SNP用HRM都好區分的,根據鹼基變異的型別,SNP可化分為四個等級,其中第IV類SNP即A/T變異,由於其Tm變化非常小(<0.2℃),被公認為是最難檢測的SNP型別,此時可以看看市場上的商品化試劑盒,比如Qiagen的,好像有一款是可以做到A/T的。
SNP可化分為四個等級
HRM法應用例項介紹
例項1:比如現在有一例人工心臟瓣膜移植患者,手術後需要使用華法林抗凝,我們需要對CYP2C9的相關基因型進行檢測(點選檢視),來進行起始用藥劑量的預測。
HRM法檢測CYP2C9基因型
例項2:一名肺腺癌患者,考慮是否使用吉非替尼,對EGFR突變進行檢測。由下圖可以看出HRM法檢出了EGFR的19del和L858R突變,HRM法不僅10%的突變可以檢測出來,1%甚至0.1%的突變也都可以檢測出來,雖然HRM的靈敏度很高,但是輕微的汙染也可導致假陽性的產生,故HRM技術方法並沒有那麼普及的應用於臨床,目前還是科研的居多。
HRM法檢測EGFR基因突變
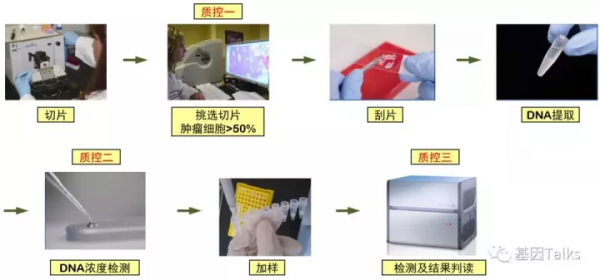
整個實驗主要操作步驟
HRM檢測技術點評
優點:
1,操作簡單,不需要探針;
2,時間快速;
3,靈敏度高,可檢測低至1%的突變;
4,只有一次開蓋過程,有效防止汙染;
5,整個操作只需Real-time PCR儀;
6,可以發現未知突變;
7,成本很低。
缺點:
1,未知突變的,不知道具體突變型別;
2,對操作人員的要求較高(輕微汙染可致假陽性);
3,對Real-time PCR儀的要求較高。
此方法適宜於有相關儀器的實驗室進行突變檢測和篩選,特別是體細胞突變。