針對人乳頭瘤病毒(HPV)和乙型肝炎病毒的疫苗,已被成功應用於相關腫瘤的預防。與此相比,治療性腫瘤疫苗的研發困難重重。理論上來說,一款優秀的治療性腫瘤疫苗,應該能把大量的、高質量的腫瘤抗原遞呈給樹突狀細胞(DC),最大程度保持DC細胞的活性,持續啟用CD4+ T細胞和CD8+ T細胞的免疫反應。
然而,自2010年sipuleucel-T(注:一款DC疫苗,將患者DC細胞從血液中分離出來,體外啟用後,再回輸到患者體內)被FDA批准用於前列腺癌的治療後(注:與對照組相比,疫苗治療組患者的生存期僅延長了約4個月),再也沒有治療性腫瘤疫苗獲批上市,一系列臨床研究得到的是陰性結果。
sipuleucel-T,圖片來自網路
失敗乃成功之母,科學家們從未放棄
分析原因,早期的治療性腫瘤疫苗簡單的認為就是給宿主補充腫瘤反應性T細胞,忽略了腫瘤細胞的免疫抗性(內在)和區域性、系統的免疫抑制(外在)。既往疫苗主要有以下幾個不足:1、免疫原性較低;2、在缺乏免疫細胞浸潤的“冷”腫瘤中進行了臨床試驗;3、受到聯合治療藥物的影響。例如:吉西他濱、環磷醯胺等化療藥物在臨床試驗中,未能有效的清除免疫抑制細胞,反而可能促進了免疫逃逸。此外,疫苗成分的遞送載體也是一大挑戰 [1]。
技術在不斷改進,腫瘤抗原的選擇是疫苗製備的焦點,目前主要有以下三種類型:一、新抗原疫苗(neoantigen vaccines):針對腫瘤突變產生的抗原,個體化新抗原疫苗的成功很大程度上取決於腫瘤突變負荷(TMB)以及抗原篩選的準確性;二、共享抗原疫苗(shared-antigen vaccines):針對非突變的腫瘤相關抗原,尤其適用於TMB低的患者。目前,也有研究嘗試聯合應用新抗原和共享抗原;三、腫瘤原位疫苗(in situ vaccines,ISVs):與傳統疫苗不同,ISVs抗原的獲取是來自腫瘤微環境中死亡或即將死亡的腫瘤細胞。ISVs的抗原並不明確,並非針對某個突變定製,只是為了改善內源性抗腫瘤反應 [1]。
2021年4月,Nature Reviews Cancer發表綜述,詳細總結了過去腫瘤疫苗失敗的一些重要原因及思考
近年來,以PD-1抑制劑為代表的免疫檢查點抑制劑(ICIs)治療,成為腫瘤治療里程碑式的進展。然而,仍舊有相當比例的患者對ICIs無應答或治療後復發。治療性腫瘤疫苗與ICIs的聯合應用,是否可以進一步提高治療應答、改善生存率,也是目前的研發重點。
新冠疫情的爆發,讓mRNA疫苗研發在歷史上留下了濃墨重彩的一筆,也讓mRNA疫苗三巨頭風光無限。除了新冠疫苗,治療性腫瘤疫苗也是三巨頭的重頭戲,它們的臨床研究都進行到哪步了?讓我們做一個簡單的盤點(注:已進入臨床研究階段的疫苗),並分享已公佈的資料。
自家的資料庫,查資料很好用!
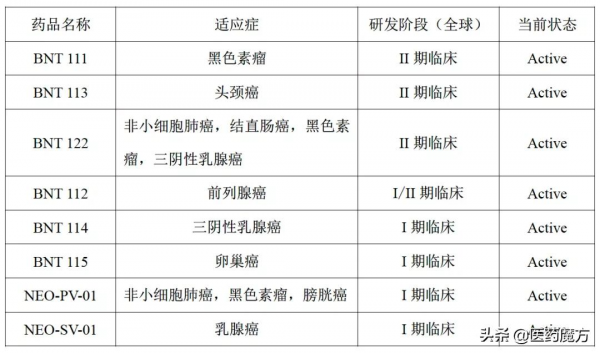
BioNTech
BNT 111 [2]
一種奈米級脂質體mRNA疫苗,編碼4種非突變的腫瘤相關抗原(TAA),包括:NY-ESO-1、MAGE-A3、tyrosinase、TPTE,這些抗原在正常組織表達有限,但在黑色素瘤中非常普遍,且免疫原性高。這裡呈現的是I期臨床研究(臨床試驗編號:NCT02410733)的探索性中期分析結果,針對不可切除的黑色素瘤患者,給與BNT111單藥或聯合PD-1抑制劑,觀察療效和安全性,目前共納入89名患者。
接種疫苗後,患者的脾臟代謝活動增加,炎症細胞因子(IFN-α、IFN-γ、IL-6、CXCL10、IL-12p70)血漿水平升高。BNT111誘匯出針對疫苗抗原強有力的CD4+ T細胞和CD8+ T細胞免疫反應。不良反應主要包括輕、中度的流感樣症狀,大部分可以在24小時內緩解。
部分患者在PD-1抑制劑治療失敗後接種BNT111,出現腫瘤退縮,病情再次進展後,又可對新一輪PD-1抑制劑治療有應答。總體來說,既往接受過ICIs治療的患者中,再次使用BNT111聯合PD-1抑制劑治療,腫瘤退縮率(tumour regression rate)超過35%,這與黑色素瘤首次接受PD-1抑制劑的緩解率相似。
BNT 122 [3]
一種陽離子脂質複合物(lipoplex)mRNA新抗原疫苗。觀察BNT122聯合PD-L1抑制劑阿替利珠單抗在區域性晚期或轉移性實體瘤患者中的療效與安全性(臨床試驗編號:NCT03289962)。研究共納入132名患者,最常見的腫瘤是NSCLC、三陰性乳腺癌、黑色素瘤、結直腸癌,39%的患者既往接受過免疫治療。大部分患者的PD-L1表達水平較低(93%的患者腫瘤細胞PD-L1表達<5%)。
有16%的患者在治療期間因疾病PD停藥。安全性方面,大多數不良反應為1~2級,未觀察到劑量限制性毒性。7名(5%)患者因研究藥物相關性AE而停止治療。在至少接受過1次用藥後評估的108名患者中,ORR為8%(9名),53名患者為SD(49%)。
NEO-PV-01 [4]
一種個體化新抗原疫苗NEO-PV-01,聯合納武利尤單抗治療晚期實體瘤的Ib期研究(試驗編號:NCT02897765)。目前共納入82名患者,包括了黑色素瘤、NSCLC、膀胱癌。患者既往接受≤1線治療,未接受過PD-1/PD-L1治療,不限制PD-L1表達水平。
患者首先接受12周的納武利尤單抗治療,後接受NEO-PV-01接種。在疫苗接種期間及接種後,均繼續使用納武利尤單抗。最終有60名患者至少接受1次疫苗治療(27名黑色素瘤,18名NSCLC,15名膀胱癌)。
安全性方面,接種疫苗後最常見的不良反應為注射部位反應(52%)和流感樣反應(35%),注射部位反應是短暫、輕度發熱或紅疹,未影響疫苗的劑量或停藥。接種疫苗的黑色素瘤、NSCLC、膀胱癌患者,ORR分別為59%、39%、27%;中位PFS分別為23.5個月、8.5個月、5.8個月。中位OS方面,黑色素瘤和NSCLC未達到,膀胱癌患者為20.7個月。1年OS率分別為96%(黑色素瘤),83%(NSCLC),67%(膀胱癌)。這些均優於PD-1抑制劑單藥治療的歷史資料。
Moderna
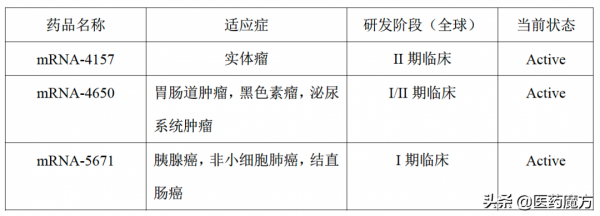
mRNA-4157 [5]
是一種脂質封裝mRNA個體化新抗原疫苗,本報告是I期臨床試驗(Keynote-603,試驗編號:NCT03313778)的更新資料。研究分為2個佇列,佇列A:實體瘤術後患者,接受mRNA-4157單藥治療;佇列B:進展/轉移性實體瘤患者,mRNA-4157聯合帕博利珠單抗治療。納入患者包括黑色素瘤、膀胱癌、HPV陰性的頭頸部鱗癌、NSCLC、SCLC、微衛星高度不穩定(MSI-H)或高TMB的腫瘤。擴充套件佇列包括:免疫檢查點抑制劑初治的結直腸癌、HPV陰性的頭頸部鱗癌患者(佇列C);黑色素瘤術後患者(佇列D)。
研究共納入79名患者,16名單藥治療,63名帕博利珠單抗聯合治療。佇列A中,14名(14/16)患者保持無病生存。佇列B中有28名患者,佇列C有27名,佇列D有8名患者,共觀察到3個CR,8個PR。在10名免疫檢查點抑制劑初治的HPV陰性的頭頸部鱗癌患者中,應答率為50%,mPFS為9.8個月,這與既往帕博利珠單抗單藥治療公佈的~14.6%和2.0個月相比有優勢。總體安全性可接受。
mRNA-5671
這是一種針對KRAS突變的mRNA新抗原疫苗,目前已進入I期臨床研究階段(試驗編號:NCT03948763),在KRAS突變的進展性/轉移性NSCLC、結直腸癌、胰腺癌患者中,評估mRNA-5671的安全性和耐受性。KRAS是細胞分化、存活的關鍵性調節因子之一,其突變可導致細胞分化和調節異常。
KRAS突變是腫瘤常見的致癌基因之一,可存在於胰腺癌、肺癌、結直腸癌等,與腫瘤發生相關的4種最常見的突變位點包括:G12D,G12V,G13D,G12C(佔KRAS突變的80%~90%)。臨床前研究顯示,注射KRAS mRNA疫苗後,CD8+ T細胞活性顯著升高。
CureVac
CV9202 [6]
是一種mRNA疫苗,編碼6種NSCLC非突變的腫瘤相關抗原,包括:NY-ESO-1,MAGE-C1,MAGE-C2,survivin,5T4,MUC-1。這是一項Ib期臨床試驗(試驗編號:NCT01915524),納入26名一線標準治療後為PR或SD的IV期NSCLC患者中,給與CV9202聯合區域性放療。
患者分為三組:一、非鱗NSCLC、無EGFR突變、基於鉑類和培美曲塞治療≥4個週期後PR/SD(n=16);二、鱗狀NSCLC、鉑類或非鉑類治療≥4個週期後PR/SD(n=8);三、非鱗NSCLC、伴EGFR突變、接受EGFR-TKI治療後(≥3個月,≤6個月)PR/SD(n=2)。一和三在接受疫苗治療後,繼續給與培美曲塞或EGFR-TKI治療。
總體治療的安全性良好,注射部位反應和流感樣症狀是最常見的CV9202相關不良事件。3名患者出現3級以上CV9202相關不良事件(乏力、發熱)。與基線相比,大部分患者(84%)的CV9202抗原特異性免疫反應增加,其中80%的患者特異性抗體水平升高,40%的患者功能性T細胞水平升高,57.7%靶病灶的最佳療效為SD。
總結
治療性腫瘤疫苗的基礎是全面瞭解腫瘤免疫的機制。臨床試驗不論是成功還是失敗,都可以帶給我們更多的資訊參考。一方面,需要提高疫苗抗原的質量;另一方面,需要改進傳遞技術。聯合傳統治療(化療,放療)或其他免疫治療(如PD-1抑制劑等),或可對腫瘤治療耐藥問題有所幫助。治療性腫瘤疫苗的未來之路,還有很長!
參考文獻
1. Nat Rev Cancer. 2021; 21(6): 360-378.
2. Nature. 2019; 565(7738): 240-245.
3. https://cancerres.aacrjournals.org/content/80/16_Supplement/CT301
4. Cell. 2020; 183(2): 347-362. e24.
5. https://jitc.bmj.com/content/8/Suppl_3/A477.1
6. J Immunother Cancer. 2019; 7(1):38.