引用本文: 楊秋瑾, 鄭傑, 楊婧, 等. 幽門螺桿菌感染對非酒精性脂肪性肝病及其相關結直腸息肉的影響研究 [J] . 中國全科醫學, 2021, 24(30) : 3855-3862. DOI: 10.12114/j.issn.1007-9572.2021.00.549.
隨著肥胖和代謝綜合徵(MetS)的流行,非酒精性脂肪性肝病(NAFLD)已成目前為全球最常見的慢性肝病,據報道,NAFLD覆蓋了全球約25%的人口,其中10%~30%為非酒精性脂肪性肝炎(NASH)[1]。從非酒精性單純性脂肪肝(NAFL)向NASH的轉變使肝硬化、肝衰竭及肝細胞癌發生風險顯著增加,約40%的NASH患者進展為肝纖維化,而肝纖維化可使NAFLD患者的死亡風險增高[2]。NAFLD發病率高、病因複雜,目前尚未明確其具體的發病機制和自然史,且無確切的治療方法。因此,探究NAFLD進展過程中的危險因素至關重要。近年研究表明,幽門螺桿菌(H.pylori)感染可能在MetS相關疾病中起作用,包括NAFLD、心血管疾病及結直腸腫瘤等[3],但有部分高質量研究否定了這種觀點[4,5]。H.pylori是一種廣泛流行的革蘭陰性螺旋桿菌,約感染全世界一半的人口,且治療相對簡單、便宜[6]。H.pylori感染與NAFLD關係的確立可能為NAFLD及其併發症的防治提供新的策略。因此,本研究對昆明醫科大學第二附屬醫院合併H.pylori感染的NAFLD患者進行了回顧性研究,以闡明H.pylori感染是否加重NAFLD的進展,並探索H.pylori感染在NAFLD患者結直腸息肉發生發展中的作用。
本研究背景:
研究表明,幽門螺桿菌(H.pylori)感染可能與非酒精性脂肪性肝病(NAFLD)及結直腸息肉均相關。鑑於H.pylori感染、NAFLD及其相關結直腸息肉的高患病率,探討H.pylori感染是否會加重NAFLD的嚴重程度和血糖、血脂、血壓等代謝指標並評估合併H.pylori感染的NAFLD患者發生嚴重結直腸息肉的風險可能為NAFLD及其相關結直腸息肉提供新的防治手段。
本研究侷限性:
本研究為回顧性研究,且樣本量較小,同時缺乏肝臟穿刺活檢結果,未對肝臟組織學進行評估。
1 物件與方法1.1 研究物件
選取2018年12月至2020年5月在昆明醫科大學第二附屬醫院經腹部B超檢查診斷為NAFLD的118例患者為研究物件,其中男60例,女58例;年齡20~85歲,平均年齡(51.4±14.7)歲。根據是否感染H.pylori將所有患者分為NAFLD合併H.pylori感染組及NAFLD不合並H.pylori感染組。所有患者在同一時間段內完善腹部超聲檢查、肝彈性成像檢查、13C尿素呼氣試驗及血液生化學檢查。
NAFLD的診斷參考中華醫學會肝臟病學分會脂肪肝和酒精性肝病學組於2010年修訂的《非酒精性脂肪性肝病診療指南》中的超聲診斷標準[7]以及2012年美國胃腸病學協會、美國肝病研究協會和美國胃腸病學院釋出的《NAFLD診斷和管理指南》[8],具體如下[7,8]:(1)空腹行腹部B超檢查發現肝脂肪變性,滿足以下超聲表現中的兩項為瀰漫性脂肪肝:①肝臟附近回聲呈瀰漫性增強,並強於腎臟和脾臟;②肝臟遠場回聲逐漸減弱;③肝內導管結構不清晰。(2)無過量飲酒史(男性飲酒摺合乙醇量<30 g/d,女性<20 g/d)和其他可以導致脂肪肝的特定原因。(3)無其他慢性肝病(包括病毒性肝炎、自身免疫性肝炎、藥物性肝病、原發性膽汁性肝硬化、膽管阻塞、血色病、威爾遜病和α-1抗胰蛋白酶缺乏相關的肝病)。
排除標準:(1)每週乙醇攝入量:男性≥140 g、女性≥70 g;(2)其他慢性肝病;(3)有腫瘤病史或當前患有腫瘤;(4)嚴重感染或器官衰竭;(5)納入研究前4周內使用鉍劑、抗生素、質子泵抑制劑或H2受體阻滯劑;(6)嚴重的精神或神經疾病;(7)處於妊娠期或哺乳期;(8)既往肝臟、胃部手術史;(9)有他莫昔芬、胺碘酮、丙戊酸鈉、甲氨蝶呤、糖皮質激素等藥物應用史;(10)全胃腸外營養、炎症性腸病、乳糜瀉、甲狀腺功能減退症、庫欣綜合徵、β脂蛋白缺乏血癥、脂質萎縮性糖尿病、Mauriac綜合徵等導致脂肪肝的特殊情況;(11)根除H.pylori治療史;(12)檢查資料不完整;(13)有結直腸病史,包括結直腸癌、結直腸息肉、炎症性腸病等;(14)結直腸手術史。
1.2 方法
1.2.1 人口學資料採集
在入院當天詳細記錄患者的性別、年齡、身高、體質量、菸酒史、服藥史及既往病史(如高血壓、高脂血症、糖尿病、肥胖等),體質指數(BMI)使用以下公式計算:體質量(kg)/﹝身高(m)﹞2。
1.2.2 H.pylori檢測
由經驗豐富的檢查員使用13C尿素呼氣試驗(HG-IRIS200A測試儀;北京海德潤醫藥集團有限公司,中國)檢測H.pylori感染情況。
1.2.3 脂肪肝和肝纖維化檢測
患者均進行FibroTouch(FT3000剪下波組織定量超聲診斷儀;無錫海斯凱爾醫學技術有限公司,中國)檢測,獲取受控衰減引數(CAP)和肝臟硬度(主要以E值反映),根據CAP將NAFLD患者脂肪衰減程度分為輕度(≥240 db/m)、中度(241~265 db/m)、重度(266~295 db/m);根據E值將NAFLD患者肝臟硬度分為輕度(<7.0 kPa)、中度(7.0~11.8 kPa)、重度(>11.8 kPa)。
1.2.4 結腸鏡檢查
患者經複方聚乙二醇電解質散進行腸道準備後,由經驗豐富的內鏡醫師完成結腸鏡檢查,發現息肉後記錄息肉的數量、位置和大小,並活檢或內鏡下切除後送病理檢查。息肉位置:近端結腸為盲腸至結腸脾曲,遠端結腸為結腸脾曲至肛門,兩側多個息肉定義為全結腸。息肉數量分為單個息肉和多個息肉(≥2個)。息肉大小分為直徑≥1 cm和<1 cm的息肉,多個息肉以最大直徑為準。根據病理檢查結果,分為增生性息肉和腺瘤性息肉。根據息肉有無上皮內瘤變,分為息肉合併上皮內瘤變和息肉不合並上皮內瘤變。
1.2.5 血液生化檢測
入院後24 h內抽取患者空腹靜脈血,應用大型全自動生化儀和配套試劑盒進行血生化、血常規、急性感染檢查。採集的指標包括:①肝功能指標:白蛋白(ALB)、丙氨酸氨基轉移酶(ALT)、天冬氨酸氨基轉移酶(AST)、谷氨醯轉肽酶(GGT)、總膽紅素(TBiL)、直接膽紅素(DBiL);②血脂指標:總膽固醇(TC)、三醯甘油(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL);③血糖:血漿空腹葡萄糖(GLU)、三醯甘油葡萄糖指數(TyG)(即TG和葡萄糖乘積的自然對數[9]);④炎性指標:白細胞計數(WBC)、中性粒細胞計數/淋巴細胞計數(NLR)、降鈣素原(PCT)、白介素6(IL-6)、C反應蛋白(CRP)。
1.2.6 NAFLD纖維化評分(NFS評分)、AST和血小板計數(PLT)比率指數(APRI)
使用NFS評分、APRI來評估肝纖維化程度。NFS=-1.675+0.037×年齡(歲)+0.094×BMI(kg/m2)+1.13×空腹血糖受損/糖尿病(是=1,否=0)+0.99×(AST/ALT)-0.013×PLT(×109/L)-0.66×白蛋白(g/dl)[10];APRI=AST/正常上限×100/PLT(×109/L)[11]。
1.2.7 MetS診斷標準
MetS的診斷依據《非酒精性脂肪性肝病防治指南(2018年更新版)》[2]中的MetS診斷標準。
1.3 倫理學審查
本研究方案嚴格遵守赫爾辛基宣言,且經昆明醫科大學第二附屬醫院倫理委員會審批(審批號:審-PJ-2020-86)。
1.4 統計學方法
採用SPSS 22.0統計軟體進行資料分析。符合正態分佈的計量資料以(x±s)表示,兩組間比較採用成組t檢驗;非正態分佈的計量資料以M(P25,P75)表示,兩組間比較採用Mann-Whitney U檢驗;計數資料以相對數表示,兩組間比較採用χ2檢驗;等級資料分析採用秩和檢驗;NAFLD患者結直腸息肉數量、息肉大小、息肉病理、上皮內瘤變的影響因素分析採用多因素Logistic迴歸分析。以P<0.05為差異有統計學意義。
2 結果
2.1 患者H.pylori陽性情況
118例NAFLD患者中H.pylori陽性62例(NAFLD合併H.pylori感染組),H.pylori陰性56例(NAFLD不合並H.pylori感染組)。
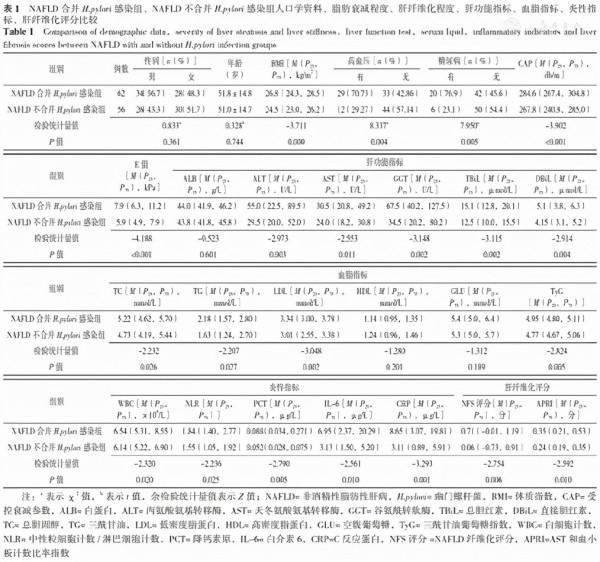
2.2 NAFLD合併H.pylori感染組、NAFLD不合並H.pylori感染組人口學資料、脂肪衰減程度、肝纖維化程度、肝功能指標、血脂指標、炎性指標、肝纖維化評分比較
兩組性別、年齡、ALB、HDL、GLU比較,差異無統計學意義(P>0.05);NAFLD合併H.pylori感染組BMI、CAP、E值、ALT、AST、GGT、TBiL、DBiL、TC、TG、LDL、TyG、WBC、NLR、PCT、IL-6、CRP、NFS評分、APRI高於NAFLD不合並H.pylori感染組,差異有統計學意義(P<0.05),見表1。
表1 NAFLD合併H.pylori感染組、NAFLD不合並H.pylori感染組人口學資料、脂肪衰減程度、肝纖維化程度、肝功能指標、血脂指標、炎性指標、肝纖維化評分比較
Table 1 Comparison of demographic data,severity of liver steatosis and liver stiffness,liver function test,serum lipid,inflammatory indicators and liver fibrosis scores between NAFLD with and without H.pylori infection groups
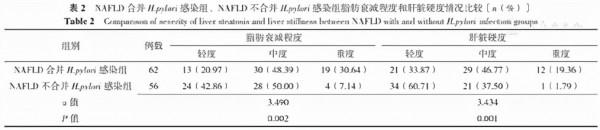
2.3 NAFLD合併H.pylori感染組、NAFLD不合並H.pylori感染組脂肪衰減程度和肝臟硬度比較
NAFLD合併H.pylori感染組脂肪衰減程度、肝臟硬度差於NAFLD不合並H.pylori感染組,差異有統計學意義(P<0.05),見表2。
表2 NAFLD合併H.pylori感染組、NAFLD不合並H.pylori感染組脂肪衰減程度和肝臟硬度情況比較〔n(%)〕
Table 2 Comparison of severity of liver steatosis and liver stiffness between NAFLD with and without H.pylori infection groups
2.4 NAFLD合併H.pylori感染組、NAFLD不合並H.pylori感染組息肉位置、息肉數量、息肉病理、上皮內瘤變情況比較
118例NAFLD患者中75例(NAFLD合併H.pylori感染組37例,NAFLD不合並H.pylori感染組38例)行結腸鏡檢查,結果示存在結直腸息肉者51例,其中NAFLD合併H.pylori陽性組26例。
75例行結腸鏡檢查的患者中,NAFLD合併H.pylori感染組存在近端結腸、遠端結腸、全結腸息肉者分別為8、6、12例,NAFLD不合並H.pylori感染組中分別為10、6、9例,兩組患者息肉位置情況比較,差異無統計學意義(χ2=0.631,P=0.729);NAFLD合併H.pylori感染組中存在單個、多個息肉者分別為5、21例,NAFLD不合並H.pylori感染組中分別為12、13例,NAFLD合併H.pylori感染組中多個息肉發生率高於NAFLD不合並H.pylori感染組,差異有統計學意義(χ2=4.747,P=0.029);NAFLD合併H.pylori感染組中息肉直徑≥1 cm和<1 cm者分別為6、20例,NAFLD不合並H.pylori感染組中分別為0、25例,NAFLD合併H.pylori感染組中息肉直徑≥1 cm發生率高於NAFLD不合並H.pylori感染組,差異有統計學意義(χ2=6.538,P=0.011)。
75例行結腸鏡檢查患者中共41例進行病理檢查。NAFLD合併H.pylori感染組中存在腺瘤性和增生性息肉者分別為18、1例,NAFLD不合並H.pylori感染組中分別為9、13例,NAFLD合併H.pylori感染組中腺瘤性息肉發生率高於NAFLD不合並H.pylori感染組,差異有統計學意義(χ2=13.137,P<0.001);NAFLD合併H.pylori感染組中存在高級別、低級別上皮內瘤變和不存在上皮內瘤變者分別為4、8、5例,NAFLD不合並H.pylori感染組中分別為0、6、18例,NAFLD合併H.pylori感染組中上皮內瘤變發生率高於NAFLD不合並H.pylori感染組,差異有統計學意義(χ2=10.752,P=0.005)。
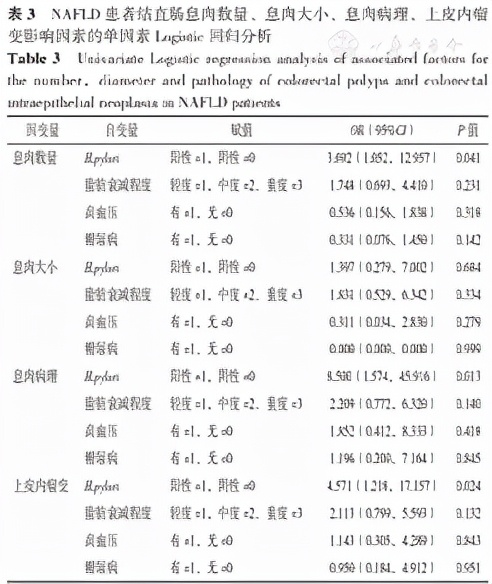
2.5 NAFLD患者結直腸息肉數量、息肉大小、息肉病理、上皮內瘤變影響因素的單因素、多因素Logistic迴歸分析
考慮到高血壓、糖尿病等代謝危險因素和脂肪肝嚴重程度本身對腸腺瘤的影響,進一步行單因素、多因素Logistic迴歸分析。分別以NAFLD患者結直腸息肉數量(賦值:單個=0,多個=1)、息肉大小(賦值:<1 cm=0,≥1 cm=1)、息肉病理(賦值:增生性息肉=0,腺瘤性息肉=1)、上皮內瘤變(賦值:無=0,有=1)為因變數,以H.pylori、脂肪衰減程度、高血壓、糖尿病為自變數進行單因素Logistic迴歸分析,結果顯示,H.pylori是NAFLD患者結直腸息肉數量、息肉病理、上皮內瘤變的影響因素(P<0.05),見表3。
表3 NAFLD患者結直腸息肉數量、息肉大小、息肉病理、上皮內瘤變影響因素的單因素Logistic迴歸分析
Table 3 Univariate Logistic regression analysis of associated factors for the number,diameter and pathology of colorectal polyps and colorectal intraepithelial neoplasia in NAFLD patients
分別以NAFLD患者結直腸息肉數量、息肉大小、息肉病理、上皮內瘤變為因變數,以表4中P<0.2的指標為自變數(賦值同單因素Logistic迴歸分析)進行多因素Logistic迴歸分析,結果顯示,H.pylori陽性、合併糖尿病是NAFLD患者結直腸息肉數量的影響因素(P<0.05);H.pylori陽性是NAFLD患者結直腸息肉病理、上皮內瘤變的影響因素(P<0.05),見表4。
表4 NAFLD患者結直腸息肉數量、息肉病理、上皮內瘤變影響因素的多因素Logistic迴歸分析
Table 4 Multivariate Logistic regression analysis of associated factors for the number and pathology of colorectal polyps as well as colorectal intraepithelial neoplasia in NAFLD patients
3 討論
研究表明,NAFLD與胰島素抵抗(IR)相關的MetS密切相關,合併MetS的NAFLD患者通常存在更嚴重的肝組織學損傷,並且進展為NASH和肝纖維化的機率更高[2]。有研究表明H.pylori感染可能與IR及MetS相關疾病有關,H.pylori在NAFLD及結直腸息肉的發生發展中均具有重要作用[3],但關於H.pylori、NAFLD及結直腸息肉三者的證據存在矛盾[4,5]。本研究旨在闡明H.pylori感染能否加重NAFLD及其相關結直腸息肉,以期為NAFLD的防治開闢新的思路。
本研究結果顯示,H.pylori陽性NAFLD患者TyG明顯升高,根據近年的研究,TyG已被描述為反應IR的生化指標[9]。此外H.pylori陽性的NAFLD患者高血壓發生率、糖尿病發生率和血脂明顯高於H.pylori陰性者,WBC、NLR、PCT、IL-6、CRP也明顯升高,證明H.pylori陽性的NAFLD患者更容易MetS和發生炎性反應。本研究結果顯示,H.pylori陽性的NAFLD患者ALT、AST、GGT明顯升高,提示H.pylori感染加重了NAFLD患者的肝功能障礙。NLR除了被廣泛用於評估炎性反應程度外,還可以預測NAFLD纖維化分期和其他組織學特徵[12],結合H.pylori陽性的NAFLD患者CAP、E值、NFS評分、APRI明顯升高,可證實H.pylori感染加重了NAFLD患者肝纖維化程度。GLU在是否合併H.pylori感染的NAFLD患者中並無統計學差異,但是TyG卻在H.pylori陽性的NAFLD患者中明顯升高,這可歸因於部分糖尿病患者服用降糖藥物。綜上,本研究表明H.pylori感染可能透過引發代謝紊亂和炎性反應增加NAFLD患者病情嚴重程度,包括肝脂肪變性程度、肝纖維化和肝細胞的損傷,這與CHEN等[13]最近發表的研究結果相似,該研究指出H.pylori感染與NAFLD患者的脂肪變性情況、嚴重程度、碳水化合物代謝異常、肝功能障礙、炎性反應加重以及MetS的發生呈正相關,H.pylori感染可能透過影響上述指標而成為預測NAFLD進展的自發性危險因素。此外,部分前瞻性研究表明,對NAFLD患者進行H.pylori根除治療可以改善患者肝纖維化及其代謝指標[14,15,16],本研究進一步證實了該結論。但也有部分研究表明H.pylori感染與NAFLD無明顯相關或僅有微弱的聯絡[4,5,17]。這可能是由於H.pylori的檢測方法以及研究設計不同,部分研究中反映H.pylori感染的血清IgG抗體陽性不能區分既往和當前感染,可能對研究結果具有干擾性。
NAFLD的臨床負擔不僅限於肝臟相關疾病,如心血管相關疾病和包括結直腸腫瘤在內的肝外惡性腫瘤是NAFLD患者主要死亡原因[18,19]。據報道,NAFLD患者患結直腸腺瘤(CRA)的風險增加,NAFLD是CRA的重要危險因素[20,21]。CRA與結直腸癌(CRC)密切相關,早期發現和切除可能在CRC的一級預防中具有重要意義。本研究結果顯示,H.pylori陽性的NAFLD患者更易出現多個腸息肉、直徑≥1cm的腸息肉、腺瘤性腸息肉,且更多的腸息肉發生上皮內瘤變;而是否合併H.pylori感染對NAFLD患者腸息肉的位置無明顯影響。上述研究結果在一定程度上表明H.pylori感染可加重NAFLD患者CRA的嚴重程度,這與AHN等[22]研究結果相似,其提出合併H.pylori感染並伴有MetS的NAFLD是大腸腫瘤的危險因素。KOUNTOURAS等[23]研究也表明H.pylori感染伴有NAFLD、MetS及腸道菌群紊亂(GM-D)可能參與CRA-CRC的發展。本研究多因素Logistic迴歸分析結果顯示,H.pylori陽性是NAFLD患者結直腸息肉數量、息肉病理、上皮內瘤變的影響因素。WANG等[24]研究結果顯示,H.pylori感染與結直腸多發性息肉、腺瘤性息肉的發生獨立相關,與息肉大小和位置無關。另有研究表明,H.pylori感染誘發的CRA主要累及左側結腸和直腸,這可能與高胃泌素促有絲分裂作用僅限於左側結腸有關;H.pylori感染可導致高胃泌素血癥及遠端結腸腺瘤發生風險增加[25]。
儘管上述研究結果存在爭議,但筆者分析認為H.pylori感染可能透過以下機制參與NAFLD及其相關CRA的發展:(1)引發或加重與IR相關的MetS。H.pylori感染可能透過調節脂聯素和胎球蛋白-A水平、引發炎性反應、改變腸道菌群以及c-Jun/miR-203/SOCS 3訊號通路介導IR的發生[3]。IR可刺激肝細胞微粒體脂質過氧化物,引發氧化應激,誘導炎性反應,導致肝細胞中脂肪分解和代謝異常,並進一步加重IR,形成惡性迴圈,加速肝纖維化進展[26]。IR時代償性升高的胰島素使胰島素結合蛋白1(IGFBP-1)水平降低而胰島素樣生長因子1(IGF-1)水平升高,後者被認為與CRC的病理、生理有關[27]。胰島素還是重要的結腸腫瘤細胞和結腸黏膜細胞生長因子,參與CRA細胞的增殖和轉移[28],同時可以促進肝內TG蓄積,使膽汁酸合成增加而促進結直腸腫瘤的發生。(2)H.pylori感染導致NAFLD患者脂聯素減少,脂聯素具有抗炎作用,可抑制結直腸腫瘤細胞增殖[29,30]。(3)改變腸道微生態。H.pylori感染可使胃黏膜萎縮,胃酸分泌減少,從而使得腸道菌群發生改變及腸道黏膜屏障破壞,這可能是NAFLD和CRA發生、發展的共同機制之一[31,32]。腸道微生態改變不僅可影響體內葡萄糖和短鏈脂肪酸的攝取和代謝並造成肝臟脂質代謝異常,還可透過增加甲基胺水平而在NASH的進展中起作用[34,35]。腸道黏膜屏障的破壞使細菌及內毒素透過門靜脈異位至肝臟,與肝細胞Toll樣受體結合,啟用肝庫普弗細胞,誘導炎性細胞因子、活性氧(ROS)及血管活性因子的釋放,促進肝星狀細胞活化和增殖,導致促炎反應,最終引起肝細胞的凋亡、壞死及纖維化[35]。此外,長期H.pylori感染還可使胃泌素釋放增加,而高胃泌素血癥可能促進結直腸腫瘤進展[25]。(4)CD44被證明在H.pylori誘導的上皮細胞增殖及炎性反應中發揮功能性作用[36]。值得注意的是,CD44可能與NASH的進展相關,且可能在NAFLD相關結直腸腫瘤的進展中具有重要意義[37,38]。
本研究具有一定的侷限性:首先本研究為單中心、小規模研究,樣本量較小;其次,本研究中NAFLD的診斷基於超聲和FibroTouch檢測結果,未進行肝臟穿刺活檢,不能準確評估H.pylori感染對NAFLD患者肝臟組織學變化的影響,但是肝穿刺活檢有創,目前尚不能推廣到普通人群。本研究中H.pylori感染與NAFLD患者結直腸息肉嚴重程度關係的多因素Logistic迴歸分析的OR值及95%CI偏大,可能與樣本量較小相關,未來需要大樣本研究進一步驗證。
綜上所述,H.pylori感染可加重NAFLD患者肥胖、高血壓、糖尿病、肝功能障礙、血脂紊亂、炎性反應、肝纖維化程度、脂肪衰減程度,此外,H.pylori感染還是NAFLD患者結直腸息肉數量、息肉病理、上皮內瘤變的影響因素。儘管機制未明,但這對於臨床醫生來說仍是一個非常重要的警示,對於合併H.pylori感染的NAFLD患者需要謹慎考慮CRA發生風險,進一步完善結腸鏡檢查。
利益衝突
本文無利益衝突。
參考文獻 略