隨著FDA在Mcl-1抑制劑領域第二次強制暫停臨床試驗,這一類癌症治療藥物正面臨新的挑戰。兩年前,由於出現心臟毒性跡象,美國FDA叫停了安進Mcl-1抑制劑AMG 397的臨床試驗。
阿斯利康目前在臨床試驗網站(clinicaltrials.gov)上更新了相關資訊,顯示其Mcl-1藥物AZD5991的I/II期研究“已被暫停,以便進一步評估安全性相關資訊。
在後續宣告中,阿斯利康的一位發言人告訴外媒,一例患者將AZD5991與venetoclax(維奈克拉)聯合使用後心髒“實驗室引數”出現升高,該公司便自願暫停使用該藥。
他們表示:”在一名復發/難治性急性髓系白血病伴其他合併症患者的心血管實驗室引數無症狀升高後,我們停止了治療,並自願暫停試驗。隨後,FDA釋出了臨床暫停令。值得注意的是,患者引數無症狀升高情況已經得到緩解。我們目前正在對研究資料進行全面分析,並與FDA密切合作,以使患者受益。”
髓系細胞白血病‐1(Mcl-1)基因是腫瘤學中眾所周知的耐藥性驅動因素,抑制 Mcl‐1基因的表達或者阻斷調節Mcl‐1基因表達的訊號途徑,能夠有效的誘導細胞凋亡,但該靶點同時也是非常難攻克的靶標。總部位於劍橋的初創公司Anji Pharma指出,6月份,當該生物技術公司從Broad Institute引進Mcl-1抑制劑時,認為他們的產品能提供更好的安全性。
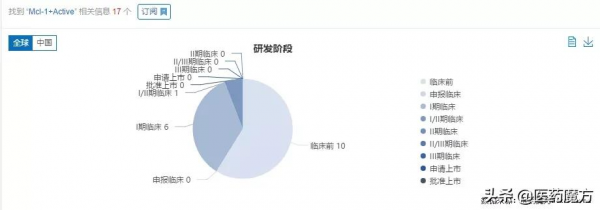
Mcl-1賽道領先藥物之一MIK665/S64315——正在由諾華和施維雅合作開發。由醫藥魔方Nextpharma資料庫可知,目前全球有17款在研Mcl-1抑制劑。
目前備受關心的問題是,導致安進藥物失敗的安全性問題是否也會阻礙阿斯利康——使其產生可能使該靶點黯然失色的潛在同類效應。
阿斯利康腫瘤學小組計劃為其研究招募144例患者,試驗預計於2023年初結束。該研究是一項3部分、多中心、開放標籤、非隨機、序貫、劑量遞增研究,以評估遞增劑量的AZD5991單藥或聯合venetoclax對復發或難治性血液系統惡性腫瘤患者的安全性、耐受性、藥代動力學和初步抗腫瘤活性。
安進AMG 397的安全問題是許多患者出現心肌酶升高情況,這同時也使另一個 Mcl-1專案AMG 176被暫停。這家制藥巨頭最終決定放棄AMG 397並將重點轉向AMG 176,這是投行SVB Leerink分析師Geoffrey Porges 一直看好的專案。