本期文獻
摘要
全直腸繫膜切除的理念為直腸癌的根治手術提供了可以遵循的質量控制標準,但是尚有部分解剖學問題存在爭議。腹腔鏡直腸癌根治術雖然具有更好的手術視野、更佳的神經功能保護、更大的操作空間,但若術者對解剖結構或解剖變異認知不足,可能會出現術中不可控制的出血、術後排尿排糞功能障礙等副損傷。筆者透過對國內外研究的分析總結,並結合臨床經驗,針對直腸癌根治術涉及的幾個解剖爭議問題,包括腸繫膜下血管解剖及變異、腸繫膜下動脈離斷平面的爭議、第253組淋巴結清掃的爭議、直腸中動脈的解剖學變異及直腸癌側方淋巴結清掃的解剖學爭議等進行闡述,旨在為臨床外科醫師提供一個更好的認知過程。
直腸癌以手術治療為主,隨著外科理念的更新和手術技術的進步,直腸癌根治手術日臻完善,為患者提供了更多的生存獲益。全直腸繫膜切除術(total mesorectal excision,TME)理念為直腸癌的根治手術提供了可以遵循的質量控制標準;但是尚有部分解剖學問題存在爭議。腹腔鏡直腸癌根治術雖然具有更好的手術視野、神經功能保護以及操作空間,但如果術者對解剖結構或解剖變異認知不足,可能會出現術中不可控制的出血、術後排尿排糞功能障礙等副損傷。筆者就目前存在的幾個解剖學爭議點和關鍵點,結合國內外研究進展及本中心經驗,進行系統闡述。
一、腸繫膜下血管解剖及變異
腸繫膜下動脈(inferior mesenteric artery,IMA)發自腹主動脈,向下延續為直腸上動脈(superior rectal artery,SRA),在距離IMA根部約4 cm處發出左結腸動脈(left colic artery,LCA)及乙狀結腸動脈(simgmoid artery,SA)。這一結構有幾處解剖學要點需要明確。
01
IMA主幹的長度存在變異:
2015年,日本的一項前瞻性研究透過術前計算機斷層掃描血管造影術(computed tomography angiography,CTA)評價IMA的解剖學變異,結果顯示,IMA主幹長度在10.1~82.2 mm之間。國內學者也報道了IMA主幹長度為(3.8±1.0)cm,最大長度達7 cm。這一點在保留LCA的手術操作時非常重要。在處理IMA根部,特別是保留LCA的第253組淋巴結清掃時,筆者建議,從IMA根部開啟血管鞘,在使用超聲刀非工作面緊貼並保護動脈壁的前提下,充分裸化IMA,尋找LCA,可以避免出現誤損傷,減少術中出血等併發症。
02
IMA動脈分支存在眾多變異:
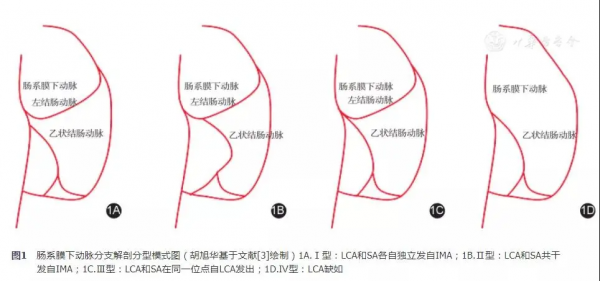
IMA分支的解剖學變異最經典的分型是Yada等在1997年提出的:Ⅰ型為LCA和SA各自獨立發自IMA(58%);Ⅱ型為LCA和SA共幹發自IMA(27%);Ⅲ型為LCA和SA在同一位點自LCA發出(15%)。日本學者Murono等在2015年對IMA分支變異分型擴充為4型,其中前3型和Yada教授一致,但是比例不同,分別為:Ⅰ型(41.2%)、Ⅱ型(9.0%)和Ⅲ型(44.7%);部分患者存在LCA缺如,被定義為Ⅳ型(5%)。見圖1。在處理IMA血管發出分支的部位時,要仔細解剖,特別是Ⅲ型,一定要注意避免損傷分支血管。
03
腸繫膜下靜脈(inferior mesenteric vein,IMV)的毗鄰關係存在較多變異:
大多數IMV自LCA下方穿過並和IMA伴行,部分患者也存在IMV自LCA上方跨越的情況。
對於直腸癌根治術來說,臨床醫師還需要格外關注邊緣動脈存在的3個解剖學薄弱區。
(1)Riolan弓是否存在。Riolan弓是LCA升支和中結腸動脈左支之間的吻合動脈,是聯絡IMA和腸繫膜上動脈(superior mesenteric artery,SMA)的重要解剖結構。國內外文獻報道,Riolan弓的解剖學變異較大,其出現率在6.2%~39.7%之間。部分學者對於是否真實存在Riolan弓這一明確的解剖結構持反對意見,認為Riolan弓僅僅是連線SMA和IMA的血管交通支,並非獨立的解剖學結構。
(2)Griffiths點處吻合情況。Griffiths點是中結腸動脈左支和LCA在脾曲處的血管吻合。Meyers透過血管造影結果顯示,Griffiths點9%患者存在吻合較差,43%存在缺如。行IMA高位離斷時,Griffiths點交通不良或缺如的患者,可能會對吻合口近端血供造成影響。筆者建議有條件的單位,可術前行血管造影或CTA明確有無血管變異,如果預估到術中高位離斷後近端血供不良,建議遊離脾曲去除更多近端腸管,以保證吻合口血運。此外,吲哚菁綠(indocyanine green,ICG)熒光顯像技術可輔助判斷腸管血運情況,精準定位擬吻合處腸管血運分界線。
(3)SA最下支和SRA之間的Sudeck危險區;見圖2A和圖2B。由於此區域常常存在血管吻合不良,術中儘可能不在此區域吻合。
二、IMA離斷平面的爭議
IMA血管離斷平面目前存在兩種主流觀點:其一是主張在IMA自腹主動脈發出後1~2 cm離斷動脈,並同時清掃系膜根部淋巴結,稱為高位離斷;其二是主張自IMA分出LCA後離斷動脈,稱為低位離斷。上述爭議的關鍵點主要是腫瘤學因素和吻合口併發症兩個方面。對於高位IMA離斷最主要的原因是腫瘤學因素。韓國一項納入了1 213例的回顧性研究結果顯示,高位離斷組淋巴結檢出數量和陽性淋巴結率更高。而國內一項1 895例的回顧性研究結果提示,低位離斷和高位離斷在3年無病生存期(disease free survival,DFS)和3年總體生存期(overall survival,OS)上差異並無統計學意義。
而在吻合口漏等併發症方面,爭議更多。2019年,Girard等透過對屍體標本進行解剖研究發現,IMA高位結紮離斷時,腸管可供吻合的長度更長,吻合口張力更低,對於低位直腸癌來說高位離斷IMA更具優勢。一項前瞻性非隨機對照研究顯示:IMA高位離斷組與低位離斷組在吻合口漏發生率上差異沒有統計學意義;低位離斷對患者排尿功能和性功能的保護似乎更為有利。瑞典一項納入14 657例直腸癌患者的研究結果顯示,高位離斷IMA會增加結腸繫膜的缺血。
一項義大利的隨機對照研究(NCT02153801)結果顯示,低位結紮IMA組患者術後排尿功能和性功能更好,但是在吻合口漏方面未見優勢。另一項研究關注了入組患者手術時間、術中出血、淋巴結檢出數以及吻合口漏發生率等指標,結果顯示,高位結紮與低位結紮組的差異無統計學意義。筆者研究團隊也進行了一項系統性綜述,評價了1990—2017年期間符合納入和排除標準的臨床研究,結果顯示,直腸癌根治手術IMA的高位離斷和低位離斷並不會對患者吻合口漏的發生、淋巴結檢出數量和5年生存率存在影響。
截止目前,對於離斷平面的高低,尚未形成共識。筆者認為,直腸癌根治手術中,需要結合患者實際情況來選擇進行IMA高位離斷還是低位離斷。低位直腸癌手術時,進行IMA高位結紮,可以降低吻合口張力;中高位直腸癌患者行保留LCA的低位離斷,需要清掃系膜根部的淋巴結,如果吻合張力較大,必要時可行脾曲遊離。
三、第253組淋巴結清掃的爭議
直腸癌根治術是否需要常規行第253組淋巴結的清掃一直存在爭議。日本結直腸癌學會最新指南,對於T3~4和(或)N+直腸癌患者推薦常規行第253組淋巴結的清掃。一項大樣本多中心回顧性佇列研究顯示,第253組淋巴結總體陽性率為1.5%,且第253組淋巴結轉移的患者5年生存率為36.2%(第253組淋巴結未轉移的5年生存率為83.3%,P<0.000 1)。
此外,對於第253組淋巴結清掃是否需要保留LCA也存在一定爭議。部分學者認為,保留LCA可能會影響第253組淋巴結清掃;但是也有學者研究發現,保留LCA同樣可以獲得良好的第253組淋巴結清掃,且並不影響患者的腫瘤學結局。筆者所在團隊的研究結果顯示,保留LCA的第253組淋巴結清掃是安全可行的,可以明顯提高Ⅲ期直腸癌患者的5年生存率。
近幾年,輔助顯像技術在手術中的應用對選擇性第253組淋巴結清掃起到了重要作用。Li等研究顯示,奈米碳示蹤可以提高術中第253組淋巴結的清掃數量。因此,對於進展期直腸癌(T3~4和或N+)推薦行保留LCA的第253組淋巴結清掃,對於無淋巴結轉移的T1期直腸癌不推薦行第253組淋巴結清掃。
四、直腸中動脈(middle rectal artery,MRA)的解剖學變異和臨床應用
MRA是一個被臨床相對忽視的概念,但是它對於直腸側方間隙的遊離和直腸全系膜切除的完成至關重要。MRA的定義並不明確,廣義上講主要是指起自髂內動脈,從側方間隙走行,穿過腹膜反折以下直腸筋膜並進入直腸固有肌層的動脈分支總稱。MRA出現頻率在12%~91%之間,可以雙側存在、雙側缺如或單側存在。關於MRA的走行方式,大多數學者認為,MRA從兩側橫向或者從側後方進入直腸是主要的解剖形式。但是,Nano等和Boxall等報道了MRA從前外側進入直腸的走行形式,且這類患者MRA通常與前列腺動脈共幹。
對於臨床應用來說,外科醫師需要特別關注以下兩個方面。(1)MRA橫行穿過直腸繫膜,按照TME原則進行直腸癌根治術需要離斷MRA,對於相對較粗的MRA來說,要嚴格止血,必要時採用雙極電凝等能量器械。筆者建議,在遊離直腸側方間隙,特別是前外側間隙時,需要向對側牽拉腸管建立足夠的張力來辨別MRA的存在和走行,避免損傷MRA導致出血。此外,MRA與盆叢支關係密切,見圖2C,遊離要在直腸和盆叢之間的間隙,緊貼直腸離斷MRA及伴行的盆叢髒支,避免由於解剖層面的偏離而導致盆叢的損傷。(2)MRA走行路徑也是側方淋巴結轉移的好發部位,術前充分的影像學評估及術中嚴格的解剖操作尤為重要。
五、直腸癌側方淋巴結清掃的解剖學基礎及臨床應用
目前,對於進展期低位直腸癌是否行側方淋巴結清掃(lateral lymph node dissection,LLND)存在爭議,爭議聚焦於側方淋巴結轉移是全身轉移還是區域性轉移。日本JSCCR結直腸癌指南對於腫瘤下緣位於腹膜反折以下、且腫瘤侵犯固有肌層以上者,即推薦行LLND;而歐美學者認為,側方淋巴結是非區域淋巴結,新輔助治療(neoadjuvant chemoradiotherapy,nCRT)已經成為標準治療方案,即使清掃,預後仍然很差,且可能增加術中副損傷。林謀斌團隊透過屍體解剖,證實了盆腔神經與LLND密不可分。Georgiou等的薈萃分析顯示,擴大淋巴結清掃與排尿和性功能障礙有關。
目前,最大的一項多中心、隨機對照、非劣效性研究JCOG0212(NCT00190541)的短期結果顯示,LLND組手術時間更長,術中出血量更多;而術後性功能障礙發生率無明顯差別。長期隨訪結果顯示,與單純TME組相比,LLND組患者5年生存率和5年無復發生存率(relapse free survival,RFS)差異無統計學意義,但是LLND組的區域性複發率更低(7.4%比12.6%,P=0.024)。目前報道的LLND組的側方淋巴結陽性率僅為7.3%(24/328)。因此,筆者不推薦常規行LLND,對於區域性進展期中低位直腸癌推薦行新輔助放化療,並根據患者精確的影像學檢查資料,追加選擇性LLND是較為科學的選擇。
六、結語
對於外科醫生來說,對解剖結構的認知是手術成功的基礎和關鍵因素之一。尤其對於直腸癌根治術來說,存在的一些解剖爭議,正是臨床中容易出現副損傷的地方。筆者從IMA的解剖變異、IMA離斷平面爭議、第253組淋巴結的清掃、MRA的變異、LLND的爭議方面進行了系統的回顧,旨在為外科醫師提供一個更好的認知過程,以完成更均質化、高標準的直腸癌根治手術。
作者:胡旭華,曹翠麗,張建鋒,牛文博,周超熙,王光林,劉友強,李保坤,王曉然,於濱,王貴英
文章來源:中華胃腸外科雜誌, 2021, 24(7)