
免疫治療太火了,奇點糕也是不想再多做描述。然而,由於個體差異等原因,免疫治療火歸火,療效卻一直是個不穩定因素,誰知道誰就是那個預後良好的幸運兒呢……
科學家們潛心尋找腫瘤生物標誌物和輔助治療方法,就想能為免疫療法對抗腫瘤時加把力。在這之中,也有不少人想著:如果能一邊吃著飯一邊就把病養好了,那該多好。

近日,一篇發表在《細胞》上的文章提出,多吃膳食纖維,能夠助力免疫治療![1]
來自美國國家癌症研究所的Romina S. Goldszmid和他的同事們發現,高纖維飲食有利於一些腸道菌群定植,這些腸道菌群透過STING-IFN-Ⅰ通路,能夠有效調節腫瘤中單核吞噬細胞(MPs)的組成,改善腫瘤微環境,提高免疫治療的療效。
越來越多的研究表明,腸道菌群對免疫治療的療效起決定性作用[2]。大家都很好奇,遠在腸道的菌群是給免疫細胞耳邊吹了什麼風兒,才能誘導腫瘤免疫。
在既往研究中,大多都在關注腸道菌群和適應性免疫之間的關係,比如改變腫瘤內CD4+T細胞、CD8+T細胞的浸潤[3]。相比之下,固有免疫就顯得有些被冷落了。
我們經常提到的固有免疫細胞有單核吞噬細胞、NK細胞等。其中,單核吞噬細胞又可進一步劃分為單核細胞(Mo)、樹突狀細胞(DC)、巨噬細胞(Mac)。
這次,Goldszmid和他的同事們想看看腸道菌群能對這些單核吞噬細胞做什麼手腳。
他們先是分別為正常小鼠(SPF)和腸菌缺失小鼠(GF)植入EL4淋巴瘤,以此來觀察腸道菌群對腫瘤中單核吞噬細胞的影響。
結果發現,這兩種小鼠的腫瘤微環境中,單核吞噬細胞的組成具有顯著差異。
在正常小鼠的腫瘤微環境中,富集的是一些有抑癌作用的單核吞噬細胞,像是樹突狀細胞、單核細胞,以及表達抗腫瘤基因(MHCIl, Cd86, Tlr2, Nos2等)的巨噬細胞;而在腸菌缺失小鼠的腫瘤微環境中,表達促癌基因(Arg1, Mrc1, Trem2, C1qa等)的巨噬細胞發生富集。
另外,腸道菌群還就只調理腫瘤這片的樹突狀細胞。不管有沒有腸道菌群,小鼠身上其它地方的淋巴結中,樹突狀細胞數量並沒有差異。
這些結果也在MC38結直腸癌、黑色素瘤、乳腺癌這三種腫瘤模型上得到驗證。
這可真是不得了,腫瘤中的單核吞噬細胞“成佛”還是“成魔”,竟是腸道菌群說了算。
所以,腸道菌群對腫瘤中單核吞噬細胞說了什麼?
Goldszmid和他的同事們發現,和正常小鼠相比,腸菌缺失小鼠的腫瘤中,IFN-Ⅰ水平明顯更低,尤其是對NK細胞的招募和啟用至關重要的IFN;一些與樹突狀細胞、單核細胞的招募、維持、功能相關的細胞因子、趨化因子也明顯更少。
而引發這一切的導火索,是單核細胞中的STING通路。
STING的全稱為干擾素基因刺激蛋白,是IFN-Ⅰ產生的主要調節因子。STING 通路在許多生理和病理過程中都佔據重要地位,比如腫瘤免疫、細胞衰老、自身免疫性疾病等。於是,STING 激動劑被科學家視為免疫治療的一個新“突破口”[4-6]。
不過,我們體內就有現成的STING激動劑生產商——腸道菌群。微生物產生的環狀二核苷酸(CDNs)能夠使STING“激動”,啟用STING通路。
在進行一系列研究後研究者們發現,腸道菌群透過cdAMP、cdGMP、cGAMP這三種CDNs來啟用腫瘤中,單核細胞的STING訊號通路,從而誘導產生IFN-Ⅰ。
而IFN-Ⅰ的水平上調,一方面增加NK細胞的數量和活性,啟用樹突狀細胞;另一方面還影響了單核細胞的分化方向,生成抑癌的巨噬細胞。

腸道菌群依賴STING-IFN-Ⅰ通路來指揮腫瘤中的單核吞噬細胞。
Goldszmid和他的同事們還用第三代鉑類抗腫瘤藥物——奧沙利鉑試了一下水,結果從療效上來看,有腸道菌群就是比沒有強!
既然腸道菌群都能命令腫瘤中的單核吞噬細胞“從良”了,那麼我們又如何“科學養菌”呢?
研究者們表示,多吃膳食纖維就好啦!
在對各種飲食方式層層篩選過後,研究者們發現,高纖維飲食下的腸道菌群能夠利用STING-IFN-Ⅰ通路這一套指揮方式來改善腫瘤微環境,誘導IFN-Ⅰ水平上升,促進單核細胞的Ifn-b1以及NK細胞的Xcl1表達量增多。
而西方飲食下的小鼠,和對照組小鼠相比,它們的腫瘤中樹突狀細胞就更少,腫瘤更大。(果不其然嘿!)
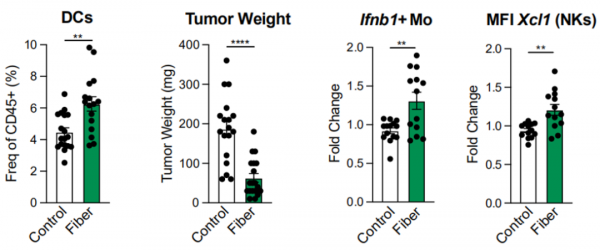
高纖維飲食下,小鼠的腫瘤微環境得到很好改善,DCs、Mo、NK細胞的活性和數量增加。
不僅如此,Goldszmid和他的同事們還對腸道菌群進行了“優選”,找出了在這條通路中指揮最賣力、最有效的菌群——Akkermansia菌群。
他們發現,和什麼菌群都沒有的小鼠相比,只有Akkermansia菌群定植小鼠的腫瘤中,樹突狀細胞明顯增多,促癌/抑癌的巨噬細胞比例也大大下降。但當單獨定植Lactobacillus reuteri等其它菌群時,效果就沒有這麼好。
剛才提到,腸道菌群要想打通腫瘤中單核吞噬細胞的任督二脈,啟用STING-IFN-Ⅰ通路,需要cdAMP、cdGMP、cGAMP來啟用單核細胞的STING。
在分析正常小鼠、僅有Akkermansia定植小鼠和腸菌缺失小鼠的腸道後發現,這三種CDNs,Akkermansia菌群都能產生,但在腸道內主要是產生的CDNs是cdAMP。
這麼看來,在腸道的芸芸眾菌之中,Akkermansia菌群是與腫瘤中單核吞噬細胞聯絡最密切的菌群了,主要透過產生cdAMP來有效調控腫瘤微環境中的單核吞噬細胞。而且膳食纖維吃得越多,Akkermansia菌群定植得越多。
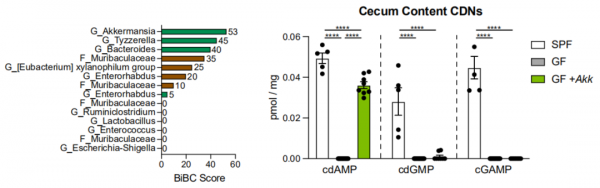
在這個通路中,Akkermansia菌群表現最積極,在腸道內主要產生的CDNs是cdAMP。
最後,Goldszmid和他的同事們還對高纖維飲食輔助免疫治療的療效進行了評估。不負眾望,高纖維飲食下,腸道菌群啟用STING-IFN-Ⅰ這條通路,改善腫瘤微環境, 確實能夠加強小鼠對免疫治療的響應。
總體來說,Goldszmid和他的同事們發現高纖維飲食有利於Akkermansia等腸道菌群定植,這些腸道菌群透過STING-IFN-Ⅰ通路誘導生成具有抑癌作用的巨噬細胞,並增加NK細胞和單核細胞、樹突狀細胞的數量和活性,從而改善腫瘤微環境,增強免疫治療的療效。
還記得前幾日一個有趣的研究麼,說高鹽飲食有助於小鼠的腫瘤免疫[7],很多人對此質疑頗多啊。大家也稍安勿躁,不管吃什麼,人肯定不能照著小鼠的吃法來啊。
不過,無論哪種飲食方式最終拔得頭籌,入選免疫治療的輔助方案,都說明一句話:保護腫瘤微環境,從腸道菌群開始做起~
參考文獻:
[1]Lam KC, Araya RE, Huang A, Chen Q, Di Modica M, Rodrigues RR, Lopès A, Johnson SB, Schwarz B, Bohrnsen E, Cogdill AP, Bosio CM, Wargo JA, Lee MP, Goldszmid RS. Microbiota triggers STING-type I IFN-dependent monocyte reprogramming of the tumor microenvironment. Cell. 2021 Oct 4:S0092-8674(21)01066-7.
[2]Sepich-Poore, G.D., Zitvogel, L., Straussman, R., Hasty, J., Wargo, J.A., and Knight, R. (2021). The microbiome and human cancer. Science 371, eabc4552.
[3]Gorjifard, S., and Goldszmid, R.S. (2016). Microbiota-myeloid cell crosstalk beyond the gut. J. Leukoc. Biol. 100, 865–879.
[4]Deng, L., Liang, H., Xu, M., Yang, X., Burnette, B., Arina, A., Li, X.D., Mauceri, H., Beckett, M., Darga, T., et al. (2014). STING-Dependent Cytosolic DNA Sensing Promotes Radiation-Induced Type I Interferon-Dependent Antitumor Immunity in Immunogenic Tumors. Immunity 41, 843–852.
[5]Flood, B.A., Higgs, E.F., Li, S., Luke, J.J., and Gajewski, T.F. (2019). STING pathway agonism as a cancer therapeutic. Immunol. Rev. 290, 24–38.
[6]Woo, S.R., Fuertes, M.B., Corrales, L., Spranger, S., Furdyna, M.J., Leung, M.Y., Duggan, R., Wang, Y., Barber, G.N., Fitzgerald, K.A., et al. (2014). STING-dependent cytosolic DNA sensing mediates innate immune recognition of immunogenic tumors. Immunity 41, 830–842.
[7]Rizvi ZA, Dalal R, Sadhu S, et al. High-salt diet mediates interplay between NK cells and gut microbiota to induce potent tumor immunity. Sci Adv. 2021 Sep 10;7(37):eabg5016.























