飢餓和進食的交替是生命最根本的生理過程,其中可發生大量的代謝狀態變化。肝臟是體內重要的代謝器官,在飢餓的過程中會響應營養缺乏訊號,進行脂肪酸氧化和酮體生成,為機體提供能量。這一過程會受到轉錄因子的調控,其中PPARα是一個核心的轉錄因子,PPARα基因缺失會導致飢餓過程中脂肪酸氧化降低。陳雁研究組前期的研究已發現PPARα會透過E3泛素連線酶HUWE1的泛素化修飾介導蛋白酶體途徑降解(Hepatology 2018, 68(1):289-303)。
近日,中國科學院上海營養與健康研究所陳雁研究組在Molecular Metabolism 期刊線上發表了題為:PAQR9 regulates hepatic ketogenesis and fatty acid oxidation during fasting by modulating protein stability of PPARα 的研究論文。
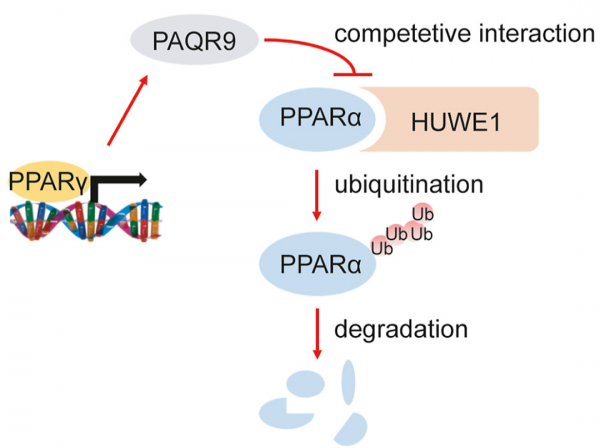
該研究首次發現內質網蛋白PAQR9能透過調節肝臟細胞的轉錄因子PPARα的穩定性,參與飢餓誘導肝臟酮體生成和脂肪酸氧化。

陳雁研究組博士研究生林毅君等人透過大資料分析和動物實驗發現,在飢餓狀態下的肝臟中,PAQR9是下調最顯著的基因之一,並鑑定出飢餓-進食過程中PAQR9的表達受到PPARγ的直接調控。
透過對PAQR9基因敲除小鼠進行一系列代謝表徵研究,發現敲除PAQR9不影響小鼠正常進食情況下的代謝狀態,但是會顯著降低小鼠飢餓情況下肝臟的酮體生成和脂肪酸氧化能力。分子機制研究發現,敲除小鼠肝臟中的PPARα,轉錄水平不會受到影響,但是蛋白含量會顯著下降。細胞實驗證實PAQR9能夠降低PPARα泛素化導致的降解。
進一步研究PAQR9對PPARα泛素化水平的調控機制,發現PAQR9能夠和介導PPARα降解的HUWE1競爭性結合以保護PPARα不被降解。體外HUWE1敲除和體內PPARα激動劑回補實驗都充分驗證了PAQR9競爭性結合HUWE1保護PPARα蛋白穩定性模型的可靠性。綜上所述,該研究揭示了內質網蛋白PAQR9能夠透過泛素化調控轉錄因子PPARα的活性,揭示了一個新的肝臟脂代謝調控機制。
中國科學院上海營養與健康研究所陳雁研究員為該論文的通訊作者,博士研究生林毅君為該論文的第一作者。該項工作得到了國家自然科學基金委和科技部的資助,也得到了中國科學院上海營養與健康研究所公共技術平臺和動物平臺的支援。
文章連結:
https://doi.org/10.1016/j.molmet.2021.101331
2020年熱文精選
1. 杯具了!滿滿一紙杯熱咖啡中,滿滿的塑膠微粒…
2. 美英澳科學家《自然醫學》再添力證:新冠病毒乃自然進化產物,或有兩種起源…
3. NEJM:間歇性禁食對健康、衰老和疾病的影響
4. 一年內治癒失眠!研究發現:改善睡眠,你或許只需要一條沉重的毯子
5. 哈佛新研究:僅12分鐘的劇烈運動,能為健康帶來巨大的代謝益處
6. 第一項人類干預試驗:在大自然裡“摸爬滾打”28天,足以提高免疫力
7. 垃圾食品是“真.垃圾”!它奪走了端粒長度,讓人老得更快!
8. Cell解謎:不睡覺真的會死!但致死的變化不是發生在大腦,而是腸道…
9. 《自然通訊》超大規模研究:血液中鐵的水平是健康與衰老的關鍵!
10. 不可思議!科學家一夜之間逆轉動物“永久性”腦損傷,還讓老年大腦恢復了年輕態…