來源:幹細胞者說
● ● ●
一個世紀以前,1型糖尿病意味著被判了死刑,而現在,它只是日常疾病。目前全球有約 4.6億糖尿病患者,每年有420萬人死於糖尿病,我國有近1.3億糖尿病患者。在 1 型糖尿病中,胰島 β 細胞遭到機體免疫系統無情地破壞,部分或完全失去了分泌胰島素的功能,造成體內胰島素絕對缺乏,引起了血糖水平持續升高,糖尿病出現了。
胰島移植雖可以改善患者的胰島素不足問題,但是供源不足,臨床上無法大規模開展。幹細胞技術的飛速發展,生物材料科學的進步,使再生醫學離臨床轉化越來越近,有望成為最有潛力的糖尿病替代治療策略。
我們不去討論造血幹細胞在 1 型糖尿病中的重要表現,也不去討論萬能寶寶間充質幹細胞作為胰島移植輔助手段的妙用。今天,我們只聊一聊幹細胞衍生的胰島β細胞在糖尿病中的應用,如果非要在前面加一個定語,那就是封裝型。
1 胰島β細胞封裝產品開發要點
臨床上,將外源胰島細胞經肝門靜脈注入體內後,患者可以擺脫對外源胰島素的依賴並可維持血糖穩態,但術後需長期服用免疫抑制劑。細胞封裝技術可以先將外源性的胰島細胞或幹細胞分化的胰島細胞置於具有免疫隔離屏障的封裝裝置後再植入體內,有望實現一勞永逸的治療效果,無需後期免疫抑制劑的使用。
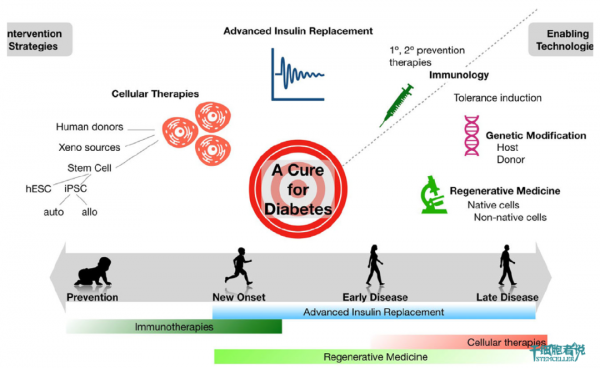
不論胰島細胞替代,還是人工胰腺,或許都是更好治療1型糖尿病的有效策略,然而都不能實現治癒。免疫調節和基因編輯可以改善胰島細胞替代的結果,或者降低1型糖尿病的發病。
很多臨床醫生不熟悉多能幹細胞向胰腺β細胞分化的策略,也不太確定多能幹細胞治療的安全性和有效性,他們認為多能幹細胞衍生的胰腺β細胞治療糖尿病屬於科幻小說的範疇。
胰島β細胞封裝技術的發展,使得1型糖尿病患者有希望獲得治癒後的新生。我們試著來闡明一下封裝型胰島β細胞產品的幾大開發要點:
移植部位的選擇
胰島移植最佳部位選擇的原則是實用性。動物模型中的胰島植入部位並不總是適合人類。比如,小鼠研究中通常首選腎包膜,顯然這是不合適人類的。儘管胰島移植到肝臟中在臨床上也是成功的,但存在出血或門靜脈血栓形成的風險,同時免疫抑制較強,因此也不大合適。移植到皮下部位,胰島又不易存活。到目前為止,大網膜是在臨床環境中適合胰島移植的最佳部位。
比起胰島移植,封裝型幹細胞衍生的胰島β細胞移植部位主要集中在皮下。因為皮下位置對於植入和恢復很便利,這個便利位置對於產品的安全性監測和療效評估(例如組織學評估)都很重要。
選擇封裝的理由
推薦臨床使用封裝的幹細胞產品原因主要有兩個:第一,封裝可以起到免疫隔離作用。第二,封裝是避免腫瘤發生可能性的一個關鍵要素。
多能幹細胞治療中最嚴重的問題無疑是畸胎瘤的形成。在最初的臨床前研究中,由於多能幹細胞受到汙染,畸胎瘤的形成是常見的事。隨著分化方案的完善和耐用封裝裝置的使用,這個問題似乎已經得到解決。在用於臨床試驗的胰腺祖細胞的分化細胞製劑中,沒有發現殘留的多能幹/祖細胞。
免疫隔離裝置
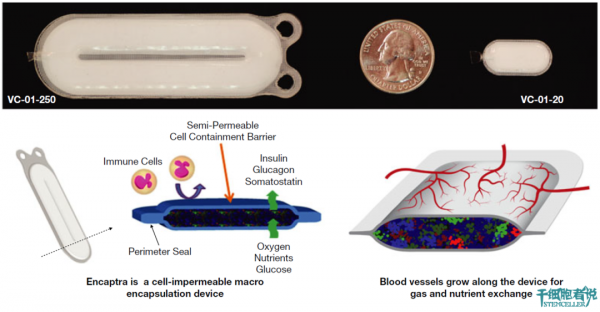
封裝裝置可以提供一個很好的免疫保護屏障,可以防止胰島細胞移植後的免疫排斥,還可以防止異體抗原的暴露,從而導致宿主的致敏。
未來實體器官移植的主要障礙可能是異體抗原。一般來說,封裝能防止移植胰島與宿主免疫細胞的直接相互作用,但並不能防止缺氧、細胞過度生長、細胞因子等對封裝裝置裡細胞的傷害。這是一個問題。
血管化
植入細胞與宿主之間的任何一種屏障,都可能會帶來功能上的問題。雖然未成熟的胰腺祖細胞似乎天生耐缺氧,但天然胰島的血管化非常好,並且本身非常喜歡富氧環境。矛盾的是,如果不突破免疫隔離屏障,細胞就不可能發生直接血管化。相反,將需要血管與封裝裝置緊密相連方可形成血管化,並需要將血管與細胞之間的距離降至最小,以便促進擴散。
免疫隔離屏障,還必須得允許氧氣、營養物質的有效擴散和代謝廢物的快速清除。最重要的是,免疫屏障不但可以允許血糖快速擴散,還不能阻礙胰島素的擴散及其進入迴圈。畢竟,血管化對於滿足成熟內分泌細胞的代謝需求是非常重要的。
生物相容性
所有用於臨床的植入裝置必須具有生物相容性。含有內分泌細胞的裝置所要求的相容性程度可能比導管、機械瓣膜等所要求的相容性大一個數量級。移植後的異物反應可能會產生短期的臨床問題,如發紅、腫脹或血清瘤等。當然也可能產生瘢痕組織,雖然不太可能對移植細胞產生功能性後果,但可能對移植進去的細胞產生一定程度的破壞作用。因此,過去可能被認為是“生物相容性”的材料,可能無法滿足活體在裝置內生存的需求。
2 胰島β細胞封裝產品開發典範
全球幹細胞衍生胰島β細胞封裝產品開發的典範,當屬美國ViaCyte公司。下面簡述一下胰島β細胞封裝產品的情況:
測試的產品是封裝裝置(Encaptra)和胰腺內胚層祖細胞產品(PEC-01)的組合。兩種尺寸的封裝裝置(En-250、En-20)已經被評估。當封裝裝置裝載了PEC-01細胞時,這些細胞被稱為VC-01-250和VC-01-20 ,展示的封裝裝置很薄(與信用卡的厚度類似),是為了減少裝置中細胞與沿裝置表面形成的血管之間的擴散距離。
ViaCyte公司最初的試驗使用了兩種尺寸的裝置:具有容納治療劑量細胞的較大的“治療性”裝置(EN-01-250)和較小的“前哨”裝置(EN-01-20)。少量的“前哨”裝置(<10)可以每隔(幾周或幾月)被植入和移除,作為追蹤植入、血管化、細胞分化和細胞移植情況的一種手段。
初步臨床試驗的報告表明,測試的產品包含兩部分,胰腺內胚層祖細胞和免疫隔離裝置。臨床試驗發現存在兩個問題。首先,在移植的“前哨”裝置中,顯示存活細胞很少,甚至沒有活細胞(不知道是否是早期缺氧的問題,因為移植的細胞顯示附近有血管生成,供氧不足)。其次,會引起強烈的細胞異物反應,極大影響植入胰腺祖細胞的存活。
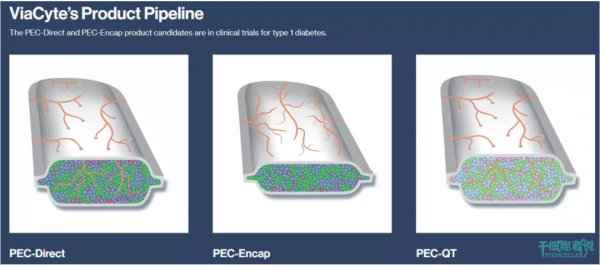
ViaCyte 公司陸陸續續開發了不少胰島β細胞封裝產品,分別是PEC-Encap、PEC-Direct及PEC-QT。前兩者的核心都是PEC-01細胞,由人源胚胎幹細胞定向分化的胰腺內胚層祖細胞,植入體內後慢慢分化成胰島素分泌細胞,從而分泌胰島素調節患者血糖。2018年6月,ViaCyte釋出了PEC-Encap針對 1 型糖尿病1/2期臨床試驗的兩年資料,結果顯示該產品安全且耐受性良好,可分化為胰島素生成細胞。2019年10月,ViaCyte釋出PEC-Direct針對 1 型糖尿病的初步療效資料,當細胞有效植入 1 型糖尿病患者體內後,可以分泌出胰島素。
3 小結與展望
1 型糖尿病的功能性治癒,一直是再生醫學領域的難題。胰島細胞移植是治療1 型糖尿病最有前景的方法之一,但受到器官供應和長期免疫抑制風險的限制。如果我們能找到一種技術:既能發揮胰島細胞分泌作用,又能避開免疫系統的攻擊。那麼,無疑是治療1型糖尿病的大殺器,而胰島β細胞封裝術正好滿足這些條件。多能幹細胞衍生的胰島β細胞有解決胰島供體不足的潛力,封裝胰腺祖細胞產品的臨床試驗已經在路上。
回顧往期,路漫漫其修遠兮,吾將上下而求索。我們將持續關注細胞治療糖尿病,直到糖尿病被治癒的那一天。
[1]Stem cell therapies for Type 1 diabetes: current status and proposed road map to guide successful clinical trials
[2]https://viacyte.com/
索取文獻,請留言
歡迎轉發,開白留言
— END —