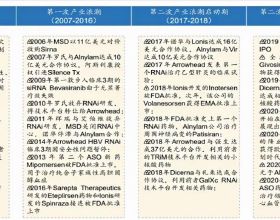
近年來,核酸藥物獲批上市的速度呈加速趨勢,多款有潛力成為重磅的核酸藥物公佈了臨床資料,覆蓋了心臟與代謝性疾病、肝臟疾病以及多種罕見病等領域。核酸藥物引發了較多的關注,有望成為繼小分子化藥和抗體藥物後的第三大型別藥物。關注行研| 核酸藥物行業研究(一)——概況及發展過程,獲取最新行業資訊。
1 核酸藥物定義
寡核苷酸是一種具有治療或控制多種疾病潛能的核酸聚合物,目前大多數寡核苷酸治療都集中在基因沉默上,也有部分用在剪接調控和基因啟用方面,寡核苷酸都透過鹼基互補配對規則與它們的同源靶分子相互作用發揮作用。
與傳統的小分子化藥和抗體類藥物在蛋白質層面發揮藥理作用不同,核酸藥物是在基因轉錄和翻譯過程中透過鹼基互補配對原則發揮作用,因此核酸藥物不存在部分靶點對小分子化藥和抗體類藥物不可成藥的限制;而且多項技術的發展改善了核酸藥物發展過程中遇到的問題,因此核酸藥物被認為擁有較大的發展前景。
截止到2020年底,全球約431個RNA靶向藥物研發專案(包括mRNA疫苗),而在這些候選藥物中,約63%處於IND前期,約32%處於早期臨床試驗(I期或II期),約3%處於臨床III期,5種藥物正在等待監管部門的審批決定。全球已有14款RNA靶向藥物獲批上市,2 款 mRNA 疫苗獲得 FDA 的 應急使用授權(EUA)。
2 核酸藥物優勢
1. 小分子藥物和抗體大分子藥物存在一定的限制
小分子化藥和抗體藥物透過與靶點蛋白結合發揮治療作用,但可成藥的靶點蛋白數量有限。自上世紀 80 年代後,基於靶點的新藥研發逐漸展開,並發現了大量的新藥;傳統的小分子化藥和抗體藥物均是透過與靶點蛋白結合而發揮藥理作用,靶點蛋白可以是酶、受體、離子通道等。儘管小分子化藥有易生產、可口服給藥、藥代動力學性質更佳、易透過細胞膜等優勢,但是其研發受到靶點可成藥性的限制(與靶點蛋白是否有合適的口袋結構、大小、深淺、極性等有關);據 Nature 2018 的一篇文章報道,人類基因組編碼的~20,000 種蛋白質中,僅有 3,000 種是可以成藥的,且只有 700 種有相應的藥物研發出來(以小分子化藥為主)。
抗體類藥物可作用的靶點位置受到限制。在小分子藥物之後,以抗體藥物為主的生物藥逐漸出現,與小分子化藥相比,抗體藥物可作用的靶點蛋白種類更多,且可透過蛋白質工程技術提升其親和性降低毒性等。但是抗體類藥物擁有分子結構更加複雜、生產成本更高、通常需透過注射給藥等劣勢,並且抗體藥物通常只能與細胞膜表面或細胞外的蛋白質發揮作用,使得其應用受到一定限制。
2. 核酸藥物有其獨特的優勢
核酸類藥物可基於鹼基互補原理對錶達相關蛋白質的基因進行調節,如 ASO(反義寡核苷酸)、siRNA(小干擾 RNA)、miRNA(微小 RNA)、saRNA (小啟用 RNA)等,而非與靶點蛋白質進行結合,且透過合適的遞送系統可使其進入細胞內發揮作用,因此核酸藥物可避免傳統小分子化藥和抗體類藥物面臨的不可成藥靶點的限制問題,而且對胞內外和細胞膜蛋白均可發揮調節作用。同時,多數核酸類藥物的作用基礎是鹼基互補配對原則,只需知道靶基因的鹼基序列,核酸藥物的序列設計就十分容易,化學修飾和遞送系統的設計與序列的設計是相對獨立的;相比之下,小分子和抗體藥物的發現和最佳化過程中,對活性、PKPD 等性質的最佳化均需要對結構做改動,需要花費大量的工作。
此外,核酸藥物擁有更廣的作用範圍。在哺乳動物的基因組中,約 70%-90%的 DNA 會被轉錄為 RNA,但並非所有的 RNA 均會被翻譯成蛋白質,存在很多非編碼 RNA(non-coding RNA),實際上,只有不足 3%的 DNA 會最終表達為蛋白質,而非編碼 RNA 在生命活動的調節中發揮著重要作用,這些都是核酸藥物潛在的作用靶點。
注:由於文章篇幅限制,小編也將後續推文中繼續補充核酸藥物關鍵技術及企業介紹,敬請期待!