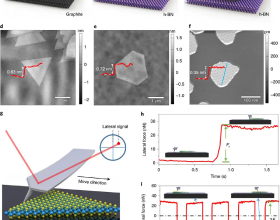
中國科學院深圳先進技術研究院合成生物學研究所副研究員戴卓君和美國杜克大學教授遊凌衝等,提出了一種全新的可模組化、多樣化融合蛋白組分的活體semi-IPN的構建思路,透過微凝膠包裹植入基因線路的兩種大腸桿菌。相關研究成果以Living fabrication of functional semi-interpenetrating polymeric materials為題,發表在Nature Communications上。
互穿網路聚合物(Interpenetrating Polymer Network)由兩種或多種各自聚合交聯的組分連續並相互穿透所組成。在IPN中,如果僅有一種聚合物是交聯的,另一種聚合物是線型非交聯的,則稱為半互穿網路聚合物(semi-IPN)。半互穿網路聚合物可以融合兩組分的特性及優點。傳統合成合成IPN或semi-IPN的方法流程繁瑣、成本較高,且合成的材料不具備復原效能,一旦其在擾動環境下失去活性,其活性便無法再生。隨著合成生物學的快速發展,利用工程細菌組裝活體材料,使其具有生物的活體效能(可再生、自修復等)成為造物致用的新方向。目前,活體材料中的“活”字多體現在材料的製備過程中,即利用生物自己產生生物膜並將全細胞構建成為材料,而在材料效能上,生物本身的特性,尤其是其活體性質缺乏較好的體現及利用。本研究中,研究人員結合合成生物學、蛋白質工程及高分子物理化學,提出透過微凝膠包裹植入基因線路的兩種大腸桿菌。微凝膠本身的交聯網路提供第一組分,並作為物理支架支援工程細菌的生長;兩種工程細菌在膠囊中生長達到一定密度後,感知到膠囊的物理空間侷限從而自主裂解,釋放出體內表達的兩種蛋白單體;兩種蛋白單體(修飾有可共價反應的蛋白標籤SpyTag或SpyCatcher)原位聚合,形成第二組分(聚合的蛋白)並與第一網路互穿。由於蛋白單體的可編輯性,可靈活的融合各種活性分子於蛋白單體,組裝修飾有各種活性蛋白模組的活體semi-IPN。
科研人員利用實驗室此前構建的ePop迴路,編輯細菌基於密度的自裂解效能。在ePop迴路的設計中,細菌表達一種來源於噬菌體phix174的E蛋白,E蛋白會阻礙大腸桿菌細胞壁的合成,當細菌密度達到一定程度時,積累的毒素便導致細菌裂解;利用彈性蛋白作為第二組分的骨架,並在彈性蛋白上融合表達多個可反應的蛋白標籤(SpyTag或SpyCatcher);構建兩種細菌,共培養兩種細菌時,細菌生長、部分裂解釋放兩種蛋白單體,兩種蛋白單體即可原位聚合;利用殼聚糖高分子作為膠囊製作的材料,利用殼聚糖與三聚磷酸分子構建交聯體系(第一網路)幷包裹兩種細菌,細菌裂解釋放的兩種蛋白單體原位聚合形成第二組分(polymerized protein),與第一網路互穿形成活體semi-IPN。
測試表明,活體semi-IPN具有更好的機械效能,並具有抵禦環境擾動的自修復效能。當製備修飾酶的活體semi-IPN,並將該酶的抑制劑短期或長期與材料共同孵育時,研究發現普通材料的酶活性全部喪失,而活體semi-IPN極高的儲存了其活性。
為進一步展示該平臺優勢及潛在的應用場景,研究團隊嘗試在一種蛋白單體下游融合β-內醯胺酶,製備融合有β-內醯胺酶的semi-IPN,並利用該材料保護抗生素擾動下的腸道菌群。研究將β-內醯胺酶融合到其中一種蛋白單體,構建活體semi-Bla-IPN。當把活體semi-Bla-IPN灌胃給小鼠時,研究發現相對於其他對照組(包括膠囊包裹純化後的β-內醯胺酶,且其含量是semi-Bla-IPN起始含量的2.5倍),服用活體semi-Bla-IPN的小鼠在菌群的總體含量及菌群結構分佈上均維持了更顯著的穩定性。
目前,活體功能材料領域聚焦於編輯及改造生物膜,研究人員試圖採用全新的思路搭建一種普適性的活體材料構建方法,並使其具有半互穿網路聚合物的良好效能。根據科研人員的設計,裂解模組和第一層網路的每一個部件均是可替換及可最佳化。例如,裂解模組的基因線路可以被替換成其他編譯細胞裂解的基因線路;第一層網路結構可以根據需求替換成其他高分子,並透過調整孔徑尺寸、表面修飾等實現效能最佳化;蛋白單體序列可以融合任意具有活性的蛋白模組;研究人員預期該方法可以設計多種具有不同功能的活體semi-IPN,包括融合多種酶利用級聯反應實現生物合成,融合重金屬結合酶或危害物降解酶實現環境保護或迴圈,以及進一步融合其他治療性蛋白實現疾病診斷及治療等。
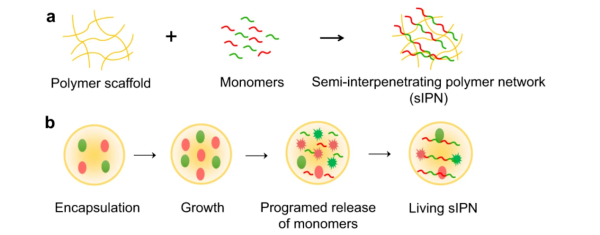
合成semi-IPN的思路。傳統的方法合成semi-IPN(a);利用合成生物學實現可模組化、多樣化融合蛋白組分的活體semi-IPN的構建思路(b)
來源:中國科學院深圳先進技術研究院