南京林大黃超伯/熊燃華團隊實現光熱電紡奈米纖維胞內遞送及其在細胞免疫治療的應用
北京時間2021年10月21日晚23時,南京林業大學黃超伯教授、熊燃華教授聯合比利時根特大學Stefaan C. De Smedt院士和Kevin Braeckmans教授在Nature Nanotechnology上線上發表了一篇題為“Photothermal nanofibers enable safe engineering of therapeutic cells”的研究型論文。
他們開發了一種新型的生物大分子胞內遞送方法,其不僅保持了光敏奈米粒在光響應胞內遞送的主要優點,同時避免了其致命缺點,即光敏奈米粒殘留在細胞內產生潛在的毒副作用。透過最佳化光敏奈米粒在奈米纖維的嵌合度,以控制作用於細胞的光熱效應,創造性地將光響應奈米粒胞內遞送與靜電紡絲技術相結合,實現了納米粒與細胞非接觸的生物大分子藥物安全高效的胞內遞送,增強生物大分子藥物藥效,有望進一步提高疾病治療效果。
中比先進生物醫用材料國際聯合實驗室(南京林業大學-根特大學)熊燃華教授為該論文的第一作者和通訊作者,黃超伯教授、Stefaan C. De Smedt院士和Kevin Braeckmans教授為共同通訊作者。
光響應奈米粒胞內遞送技術的遞送效率依賴於光敏奈米粒與細胞緊密黏附,其潛在的毒副作用阻礙了該方法進一步向臨床應用快速轉化。例如,在脈衝光作用下,光敏奈米粒碎裂成只有幾奈米的粒子殘留在細胞內,可能導致細胞意外的基因突變。在細胞治療中,這一問題尤其值得關注,因為治療細胞的基因突變可能導致意外的毒副作用。因此,亟需構建一種新的生物醫用光響應材料,以避免細胞與光敏奈米粒直接接觸,但同時又不妨礙光敏奈米粒產生的光熱效應增強細胞膜通透性,實現光敏奈米粒與細胞非接觸的生物藥物安全、高效的胞內遞送。
圖1:研究成果設計圖。
針對上述難點,研究團隊在生物醫用光響應奈米纖維的構建及其生物大分子藥物胞內遞送的應用開展了基礎、系統、深入的研究(如圖1和圖2a)。主要研究內容包括:(1)研究了光敏奈米粒嵌合的奈米纖維結構與胞內遞送效率的構效關係;重點關注靜電紡絲製備引數,控制嵌合光敏奈米粒與纖維表面接觸的細胞距離,以保證嵌合光敏奈米粒生成的光熱效應能有效增強細胞膜通透性,得到最優光響應奈米纖維結構,用於生物大分子藥物胞內遞送;(2)進一步,研究了光響應奈米粒生成的光熱效應與細胞膜作用機理;主要關注光輻照光敏奈米粒生成光熱效應的過程,及其作用於細胞膜增強細胞膜滲透性的機制;(3)應用小鼠模型,採用最優光響應奈米纖維遞送生物高分子藥物小干擾核酸到人體免疫T細胞內,以形抑制PD-1蛋白的表達,從而提供治療T細胞(CAR-T細胞)抑制腫瘤增長,最終達到增強治療效果的目的。主要實驗原理如下:如圖2a左上圖所示,在光輻照前,細胞黏附在光敏奈米粒嵌合的奈米纖維上;當光輻照奈米纖維負載的光敏奈米粒,激發光敏奈米粒產生光熱效應作用於細胞膜(圖2a左中圖);合理的奈米粒嵌合度保證了光熱效應能有效作用於細胞膜,增強其通透性,但又不與細胞直接緊密接觸(圖2a右上圖);分散在胞外的生物大分子藥物透過區域性通透的細胞膜擴散進入胞內,實現安全高效生物大分子藥物胞內遞送(圖2a左下圖);主要取得如下研究成果。
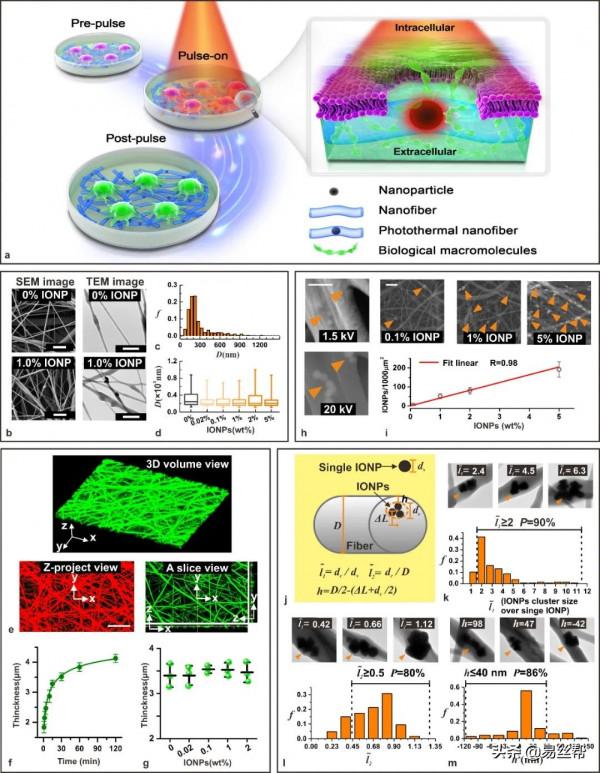
1 光熱奈米纖維的製備與表徵。
光熱奈米纖維由聚合物(PCL)和氧化鐵奈米粒(IONP)的混合物電紡製備而得。掃描電子顯微鏡(SEM)和透射電子顯微鏡(TEM)結果顯示:在不同奈米粒的濃度,奈米纖維的平均直徑約為300 nm(圖2b-d)。透過共聚焦顯微鏡觀察發現,靜電紡絲1 h後,纖維膜的厚度逐漸增加到4µm(圖2e,f)。當新增IONPs時,纖維膜的厚度沒有明顯變化(圖2g)。當IONP含量從0.02%增加到5%時,氧化鐵奈米粒面積密度從1.7團簇/1000µm²線性增加到192團簇/1000µm²(圖2i)。進一步,透過定義三個參量,分析了IONPs在奈米纖維中的分佈情況(圖2j-m)。
圖2:光熱奈米纖維胞內遞送概念及光熱奈米纖維的表徵。(a)光熱奈米纖維的胞內遞送原理示意圖。(b)含有0和1 wt%光響應奈米粒的奈米纖維的SEM和TEM影象。(c)不含奈米粒的奈米纖維直徑分佈圖。(d)含不同奈米粒(0 - 5%)的奈米纖維直徑。(e)奈米纖維(不含奈米粒)的共聚焦顯微鏡影象。(f)纖維膜厚度隨著靜電紡絲時間的變化。(g)30 min紡絲後,奈米纖維膜厚度與含奈米粒的關係。(h)20 kV的SEM成像清楚地顯示了納米粒在纖維內部(下),而在1.5 kV較低電壓下則不是這樣。(i)單位面積的奈米粒團簇與奈米粒含量的關係。(j-m)奈米粒在奈米纖維中的分佈示意圖以及相應結果。
2 光熱奈米纖維高效、安全的大分子胞內傳遞。
首先,光熱奈米纖維被證明能高效、安全遞送大分子到HeLa貼壁細胞。透過共聚焦顯微鏡影象結果定量分析,得到增加鐳射能量密度或奈米粒的含量能提高遞送效率,但細胞毒性也逐漸增加;發現當鐳射能量密度為0.08 J/cm2和奈米粒含量為1%時,得到最優胞內遞送結果(圖3a)。接下來,測試了光熱奈米纖維對Jurkat懸浮細胞的遞送效率。發現當鐳射能量密度為0.16 J/cm2和奈米粒含量為2%時,得到最優胞內遞送結果(圖3b)。最後,質譜檢測結果表明包裹在奈米纖維中的奈米粒沒有洩露到溶液或細胞(圖3c-f)。
圖3:光熱奈米纖維高效、安全的大分子胞內傳遞。(a)紅色熒游標記的10 kDa葡聚糖(RD10)的HeLa貼壁細胞遞送效率、存活率與鐳射能量密度、光敏奈米粒含量的關係。(b)Jurkat懸浮細胞遞送效率、存活率與鐳射能量密度、光敏奈米粒含量的關係。(c-d)光照射後ICP-MS/MS測定細胞中Fe含量的實驗示意圖;不同實驗條件下,Fe含量的測量結果。(e-f)光照射後ICP-MS/MS測定水溶液中Fe含量的實驗步驟示意圖,以及不同實驗條件下的Fe含量的測量結果。
3 區域性瞬態熱效應是光熱奈米纖維增強細胞膜通透性的主要原因。
實驗結果證明了光化學反應如活性氧(ROS)的產生不是增強細胞膜通透性的主因,因為該項研究中使用的脈衝寬度(7 ns)不太可能引起光化學反應使得細胞膜通透性增強(一般,光化學反應採用超快飛秒脈衝鐳射與光敏奈米粒作用產生)。這也意味著光熱機制是導致細胞膜通透性的主要原因。而光熱機制通常有兩種形式:奈米氣泡造成的區域性細胞膜穿孔,或者透過熱傳遞導致細胞膜通透性增強。實驗結果表明:奈米氣泡生成需要當前採用最高的鐳射能量密度的數十倍之高,因此也可以排除奈米氣泡造成細胞膜穿孔作為主要機制。透過上述排除法,證實了熱傳遞是細胞膜通透性增強的主要機制。其過程是奈米纖維內的光敏奈米粒簇在脈衝光作用下,區域性溫度迅速升高,使得細胞與奈米纖維接觸的區域性細胞膜通透性增強(圖4a)。最後,理論數值模擬了脈衝鐳射照射光敏奈米粒後的熱傳遞過程以及主要影響引數(圖4b-j)。
圖4:區域性瞬態熱效應是光熱奈米纖維致細胞膜通透的主要原因。(a)鐳射誘導光熱奈米纖維產生熱效應及熱傳遞示意圖。(b)採用紫外-可見光譜法測量得到160 nm光敏奈米粒的消光光譜以及根據Mie理論計算結果。(c)光敏奈米粒在647 nm吸收7 ns脈衝鐳射溫度升高的計算結果。(d)0.08 J/cm2鐳射能量密度照射下誘導光熱奈米纖維產生熱效應及其熱傳遞的結果。(e-f)平均溫度和有效熱效應面積隨著時間的變化。(g-j)平均溫度和有效熱效應面積在不同奈米粒聚合情況隨著鐳射能量密度的變化。
4 光熱奈米纖維應用於生物大分子siRNA或CRISPR/Cas9的胞內遞送研究。
成功實現模型大分子胞內遞送後,光熱奈米纖維進一步被應用於生物功能大分子siRNA或CRISPR/Cas9的胞內遞送。首先,光熱奈米纖維將抗綠色熒光蛋白(GFP)的siRNA遞送到穩定表達GFP的H1299細胞中。研究結果表明隨著siRNA濃度(0.5,1,2和5µM)的增加,GFP的靜默效率越高,同時不影響細胞活性(圖5a-f)。接著,光熱奈米纖維將敲除GFP表達的RNPs遞送到H1299細胞中。研究結果表明GFP的敲除效率隨著RNP濃度的增加而增加,最高RNP濃度的GFP敲除效率可達80%(圖5g-j)。
圖5:光熱奈米纖維應用於生物大分子siRNA或CRISPR/Cas9RNPs的胞內遞送研究。(a)光熱奈米纖維將siRNA或RNPs遞送到H1299細胞以抑制或敲除綠色熒光蛋白(GFP)表達的實驗示意圖。(b)共聚焦顯微鏡影象顯示了對照和siRNA胞內遞送的H1299細胞GFP的表達。(c)相應的流式細胞儀直方圖結果。(d-f)24小時後H1299細胞在不同情況下的GFP表達和活性結果。(g-h)光熱奈米纖維將RNPs遞送到H1299細胞以敲除GFP表達;共聚焦顯微鏡影象和相應的流式細胞儀結果。(i-j)48小時後H1299細胞在不同情況下的GFP敲除和活性結果。
5 光熱奈米纖維應用於人胚胎幹細胞(hESC)高效安全的生物大分子胞內遞送。
在該工作中,光熱奈米纖維還被應用於細胞治療相關的人胚胎幹細胞(hESCs)的胞內遞送。實驗結果表明隨著遞送效率逐漸提高,但同時細胞活性也降低了;當I=0.08 J/cm2時,獲得最優遞送效率為63%;與此相比,傳統電穿孔方法在最優程式(CE-118)的遞送率僅為25%(圖6a-d)。同時,研究結果表明光熱奈米纖維處理後的人胚胎幹細胞不影響幹細胞功能特性(圖6e-i)。最後,光熱奈米纖維成功的應用到遞送RNPs到hESCs細胞,以敲除X染色體上的IL-2Rgamma(IL-2R)基因表達(圖6j-k)。
圖6:光熱奈米纖維應用於人胚胎幹細胞(hESC)高效安全的生物大分子胞內遞送。(a)不同實驗條件下,hESC胞內遞送效率和細胞活性。(b)不同電穿孔條件下的hESC遞送效率和細胞活性。(c)共聚焦顯微鏡影象顯示了hESC遞送效率和細胞活性。(d)在最優光熱奈米纖維和電穿孔實驗條件下處理hESC後,24 h後兩者細胞存活率和遞送效率。(e)最優實驗條件下處理hESC後,細胞生長效率。(f)光熱奈米纖維處理hESCs24小時後,轉錄因子Oct4 (Pou5f1)、Sox2和Nanog免疫染色共聚焦顯微鏡影象。(g)Oct4 (Pou5f1)、Sox2和Nanog轉錄因子的量化結果。(h)標記特異蛋白TNNT2和NKX2.5的免疫染色共聚焦影象展示了hESCs分化為心肌細胞。(i)心肌細胞TNNT2和NKX2.5的量化結果。(j)hESCs在不同實驗情況下的Sanger基因序列。(k)透過Sanger測序分析了IL-2R敲除效率。
6 光熱奈米纖維應用於人T細胞高效安全的生物大分子胞內遞送。
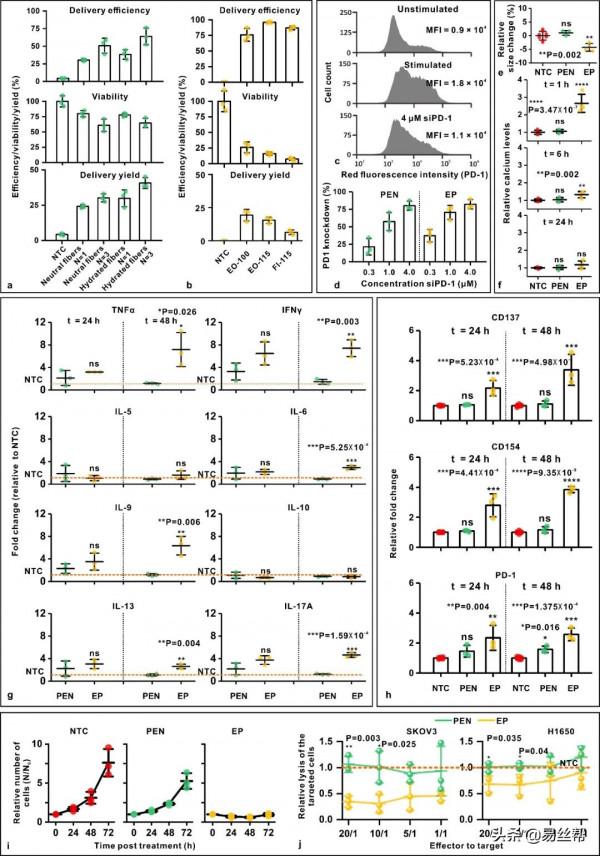
最後,光熱奈米纖維被應用於人供體來源的T細胞的胞內遞送。研究發現光熱奈米纖維的最佳遞送效率為40.7%,而傳統電穿孔方法為19.3%,儘管在遞送siRNA以抗PD-1蛋白表達效率類似(圖7a-d)。為保證遞送安全性,遞送方法應該最小限度地干擾治療細胞的功能特性。結果表明光熱奈米纖維對T細胞形態、表型、啟用狀態的功能沒有顯著影響,而以此相反的是電穿孔對T細胞功能影響較大(圖7e-f)。最終導致了電穿孔處理的T細胞在目標細胞殺傷功能減弱,而光熱奈米纖維處理的T細胞能保持原有功能特性(圖7i-j,圖8)。
圖7:光熱奈米纖維應用於人T細胞高效安全的生物大分子胞內遞送。(a)光熱奈米纖維應用於T細胞遞送。(b)電穿孔後的T細胞遞送。(c-d)光熱奈米纖維和電穿孔方法遞送小干擾核酸siPD1到T細胞以抑制PD1蛋白表達。(e)光熱奈米纖維和電穿孔方法處理T細胞1小時後,對細胞尺寸的影響。(f)光熱奈米纖維和電穿孔方法處理T細胞後,相對鈣離子隨時間的變化。(g)光熱奈米纖維和電穿孔方法處理T細胞後,幾種關鍵促炎或抗炎細胞因子的分泌情況。(h)光熱奈米纖維和電穿孔方法處理T細胞後,啟用標記物CD137、CD154以及PD1的蛋白表達情況。(i)光熱奈米纖維和電穿孔方法處理T細胞後,細胞的增殖情況。(j)光熱奈米纖維和電穿孔方法處理T細胞後,細胞在體外對目標細胞殺傷情況。
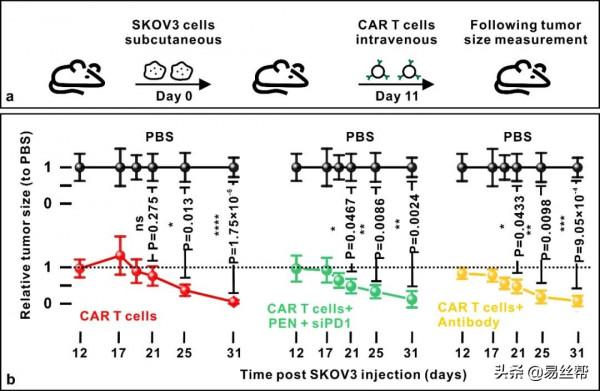
圖8:光熱奈米纖維處理後的T細胞在體內保持著細胞功能特性。(a)光熱奈米纖維將siRNA遞送到CAR-T細胞以證明在SKOV3腫瘤小鼠模型有效性的實驗示意圖。(b)靜脈注射CAR-T細胞(陰性對照,n=5)、光熱奈米纖維將siPD1遞送到CAR-T細胞(實驗組,n=4)、CAR-T細胞聯合PD1-抗體給藥(陽性對照,n=4)的腫瘤大小隨時間變化。
總之,該工作開發了一種新型的生物大分子胞內遞送方法,其不僅保持了光敏奈米粒在光響應胞內遞送的主要優點,同時避免了其致命缺點,即光敏奈米粒殘留在細胞內產生潛在的毒副作用。透過最佳化光敏奈米粒在奈米纖維的嵌合度,以控制作用於細胞的光熱效應,創造性地將光響應奈米粒胞內遞送與靜電紡絲技術相結合,實現了納米粒與細胞非接觸的生物大分子藥物安全高效的胞內遞送,增強生物大分子藥物藥效,有望進一步提高疾病治療效果。
該成果得到了國家自然科學基金專案、南京林業大學標誌性成果培育專案等資助。
相關論文資訊:
https://doi.org/10.1038/s41565-021-00976-3