人類一直有“長生不老”的夢想,而作為機體最大器官的面板,是個體看起來是否年輕的關鍵決定因素。
近日,來自中科院上海營養與健康研究院的張亮團隊,在《自然·衰老》雜誌發表了關於防止面板衰老的重要研究成果[1]。
他們藉助巧妙的小鼠模型,揭示了MiR-31透過MAPK/ERK通路調控生物毛囊幹細胞功能,驅動了面板衰老。
特別具有臨床意義的是,他們發現已獲批的MAPK/ERK抑制劑能阻斷這一過程,從而防止面板老化。
面板衰老可以體現在多個方面,例如毛髮變白、變細、皺紋的出現,以及傷口癒合的延遲等。以往機制研究提示,對於表皮這樣處於不斷快速更替的組織,其衰老大多可以歸因於常駐幹細胞的消失[2]。
毛囊幹細胞位於表皮毛囊隆突部,它是調控毛髮週期性生長的決定因素。紫外線以及輻射等外界因素,能透過改變毛囊幹細胞基因組穩定性而加速面板衰老,然而何種內在因素驅動了毛囊幹細胞衰老尚不清楚。
以往研究闡釋了多種轉錄因子在毛囊幹細胞衰老中的作用,然而MicroRNA(MiR)在其中的調控作用尚不清楚。
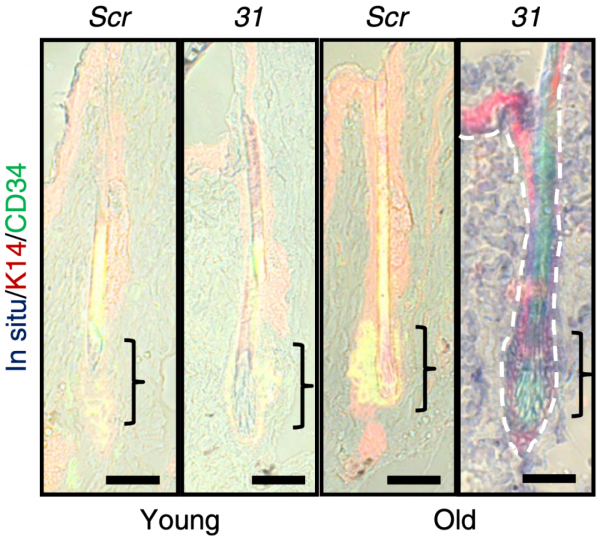
為了找到調控毛囊幹細胞功能的關鍵內源性MiR,張亮團隊首先從年輕的8周齡小鼠,和年老的22月齡小鼠的背部面板獲得單個表皮細胞,經過測序發現MiR-31等顯著升高,且原位雜交提示這些升高的MiR-31多位於毛囊幹細胞所處的隆突處。
為了驗證面板衰老後MiR-31升高這一現象,張亮團隊又檢測了年老的人面板中MiR-31的表達水平,發現MiR-31顯著升高。
此外,張亮團隊還構建了一種輻照誘導的面板衰老模型,經輻照處理後,小鼠的面板出現了毛髮變白、皮脂腺縮小以及創傷癒合延遲等面板衰老的表現,而且MiR-31在這一過程中也顯著升高。
以上研究結果說明,MiR-31確實與面板的衰老密切相關。
為了探究毛囊幹細胞在輻照誘導面板衰老中的作用,張亮團隊用示蹤方法標記了小鼠的毛囊幹細胞,結果發現輻照促進小鼠毛囊幹細胞分裂增殖,而且分裂產生的後代細胞會從隆突部逐步進入到表皮之間。不過,沒有接受輻照的小鼠不存在這一現象。
需要指出的是,輻照小鼠毛囊幹細胞的數量在這一過程中會逐漸減少。實際上,以往研究表明這種透皮分化是毛囊幹細胞減少的重要途徑[2]。
那MiR-31和毛囊幹細胞的透皮分化,以及面板衰老之間是什麼關係呢?

輻照(Rad)導致毛囊幹細胞來源的細胞(綠色GFP訊號)出現在小鼠表皮
為了闡明MiR-31透過何種機制導致了面板衰老,張亮團隊構建了在表皮特異性誘導過表達MiR-31的小鼠,觀察發現MiR-31的過表達使得小鼠過早的出現毛髮稀疏等面板衰老的表現。

相比於野生型小鼠(WT),表皮過表達MiR-31小鼠(DTG)出生後55天(P55)即表現出毛髮稀疏等面板老化表現,這一現象在小鼠年老後更為明顯
究其背後原因,原來是MiR-31過表達使得毛囊幹細胞出現了明顯的透皮分化,示蹤小鼠的實驗也再現了這一結果。
如此看來,是MiR-31的過表達促進了毛囊幹細胞的透皮分化,進而導致面板衰老。這提示在小鼠自然老化的過程中,表皮MiR-31本身作為內源性因素,能夠驅動面板衰老。

在MiR-31過表達小鼠(DTG)中,綠色標記的毛囊幹細胞來源細胞逐步出現在毛囊之間的表皮
為了進一步驗證MiR-31的作用,張亮團隊在小鼠的表皮特異性敲除MiR-31基因,發現該小鼠在年老時的面板看起來依然年輕。其面板創口癒合能力也比野生型小鼠強。
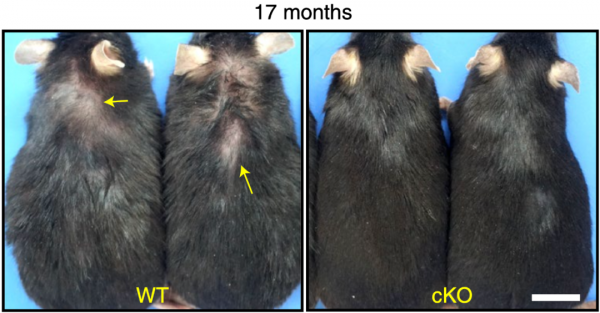
在17月齡時,與同齡野生型(WT)對照小鼠相比,表皮特異性敲除MiR-31小鼠(cKO),其面板看起來更有光澤,顯得更為年輕
為了找尋MiR-31發揮作用的分子機制,張亮團隊透過篩選發現,過表達MiR-31小鼠中,ERK通路顯著活化,且ERK在MiR-31表皮特異性敲除小鼠中被抑制。隨後的體外細胞系研究表明:MiR-31透過結合Clock基因的UTR區域,調控CLOCK蛋白表達,進而調節表皮細胞ERK的活化,調節毛囊幹細胞功能。
讓人興奮的結果來了,既然ERK是介導MiR-31作用的關鍵訊號通路,那麼已經批准應用於臨床的該通路抑制劑能否阻止面板老化呢?
帶著這個問題,張亮團隊想到了曲美替尼(Trametinib),這是一種MEK1/2的抑制劑[3],國內已經批准用於黑素瘤的治療,而MEK正是ERK的上游通路,抑制MEK1/2能夠降低ERK的活化。
在表皮過表達MiR-31的小鼠中,口服曲美替尼使得毛囊幹細胞經皮分化顯著減少,從而減緩了該小鼠的面板衰老。

綠色的數量代表毛囊幹細胞來源的細胞,其出現在了表皮的位置提示有經皮分化,數量越多提示毛囊幹細胞耗竭越多
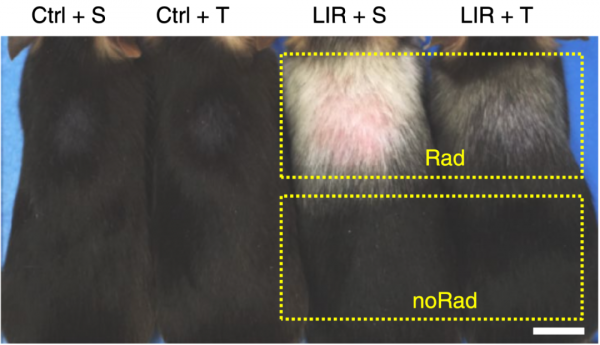
在輻照誘導的面板衰老模型中,口服曲美替尼顯著改善了小鼠毛髮變白的狀況,而輻照部位絕大部分毛囊也生存了下來。
對於靶向面板的藥物,外用相較於口服更為適合,因此張亮團隊探究區域性外塗是否能發揮類似的作用,為此他們用把曲美替尼做成了一種可以外用的劑型,讓人眼前一亮的是,僅外塗一次就能夠顯著改善輻照誘導的毛髮變白。
其實,MEK抑制劑或者ERK抑制劑早已在臨床上應用,面板科醫生常遇到因為口服這兩類藥物而導致的毛囊性丘皰疹,這也是部分患者停藥或者減量使用藥物的重要原因之一[4]。
至於MEK抑制劑為何會導致主要以毛囊性丘皰疹為主的皮損,有機制研究發現,這一現象與MEK抑制劑能夠調控表皮的白介素36γ以及痤瘡丙酸桿菌有關[5]。
總的來說,張亮團隊的研究成果雖然找到了一種延緩面板衰老的潛在方法,但是仍需要更多的研究來證明這一發現的可行性。
比如,那些口服MEK或者ERK抑制劑患者表皮MiR-31的改變情況如何?口服MEK或者ERK抑制劑,是否阻止了患者的面板衰老呢?
此外,文中證明MEK或者ERK抑制劑能夠阻止輻照誘導的小鼠面板衰老,但是對於生理性衰老的作用尚不清楚,MEK或者ERK抑制劑的長期應用仍需謹慎權衡利弊。
參考文獻:
1. Matsumura H, Mohri Y, Binh NT, et al. Hair follicle aging is driven by transepidermal elimination of stem cells via COL17A1 proteolysis. Science. 2016;351(6273):aad4395. doi:10.1126/science.aad4395
2. Ermolaeva M, Neri F, Ori A, Rudolph KL. Cellular and epigenetic drivers of stem cell ageing. Nat Rev Mol Cell Biol. 2018;19(9):594-610. doi:10.1038/s41580-018-0020-3
3. Escuin-Ordinas H, Li S, Xie MW, et al. Cutaneous wound healing through paradoxical MAPK activation by BRAF inhibitors. Nat Commun. 2016;7:12348. Published 2016 Aug 1. doi:10.1038/ncomms12348
4. Wang CJ, Brownell I. BRAF Inhibitors for the Treatment of Papulopustular Eruptions from MAPK Pathway Inhibitors. Am J Clin Dermatol. 2020;21(6):759-764. doi:10.1007/s40257-020-00539-7
5. Satoh TK, Mellett M, Meier-Schiesser B, et al. IL-36γ drives skin toxicity induced by EGFR/MEK inhibition and commensal Cutibacterium acnes. J Clin Invest. 2020;130(3):1417-1430. doi:10.1172/JCI128678
責任編輯丨BioTalker