作為一種獨特的第二信使,鈣離子(Ca2+)在調控細胞增殖、生存、凋亡和免疫反應等生物學過程中發揮重要作用。並且透過多種型別的離子通道介導Ca2+在細胞內外的轉運及Ca2+與細胞內多種蛋白的結合,Ca2+訊號通路參與腫瘤、自身免疫性疾病和病毒感染等多種型別疾病的發生發展。
近日,徐州醫科大學孔凡運博士(第一作者)、湯仁仙教授(通訊作者)和鄭春福教授(通訊作者)在International Journal of Biological Macromolecules(IJBM)發表綜述:The crosstalk between pattern-recognition receptor signaling and calcium signaling, 系統綜述了相關領域的最新研究進展,總結了Ca2+訊號通路與模式識別受體(Pattern-recognition receptors, PRRs)訊號通路在調節天然免疫中的相互作用及其分子機制。
該文重點闡述了Ca2+訊號通路與PRR訊號通路在天然免疫中的相互調節功能。天然免疫在控制外源性病原微生物感染和內源性危險訊號的過程中發揮重要的作用。經典的PRRs包括Toll樣受體(Toll-like receptors, TLRs),視黃酸誘導基因1樣受體(retinoic acid inducible gene I -like receptors, RLRs),細胞內DNA感受器(cytosolic DNA sensors)和核苷酸寡聚結合域樣受體(Nod-like receptors, NLRs)。這些受體啟用後能夠NF-kB訊號通路啟用和I型干擾素(Type I interferon, IFN-I))釋放及下游JAK-STAT (Janus kinase-signal transducer and activation of transcription) 訊號通路的啟用。
文章主要內容
1、TLR與Ca2+訊號通路
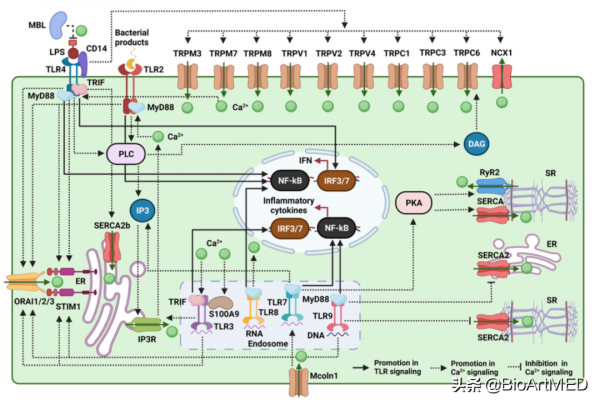
Ca2+訊號通路透過胞質中Ca2+水平的升高和降低進行控制,胞質中的Ca2+水平的調節依賴於位於細胞膜和不同細胞器,包括內質網、肌漿網、高爾基體、線粒體和溶酶體上的Ca2+通道,例如,透過細胞膜上的TRP和ORAI通道,Ca2+進入到細胞質中;透過PMCA和NCX通道,Ca2+轉運到細胞外;透過SERCA通道,Ca2+進入到內質網中;透過IP3R和RYR通道,Ca2+轉運到內質網外;透過MCU和VDAC通道,Ca2+進入到線粒體中;透過mNCX通道,Ca2+轉運到線粒體外。目前的研究表明,TLR2、TLR3、TLR4、TLR7、TLR8和TLR9能夠透過調控細胞膜和細胞器上的不同Ca2+通道的活性調節Ca2+訊號通路,進而調節免疫細胞的啟用,細胞因子的產生、炎症反應和抗病毒固有免疫反應。反過來,Ca2+訊號通路透過調控TLR的表達和活化,調控TLR訊號通路的活化。
圖1. TLRs與Ca2+訊號通路的相互作用
2、RLRs和DNA感受器與Ca2+訊號通路
RLRs主要由位於細胞質中的識別來源於病毒的雙鏈RNA(dsRNA)的RIG-I、LGP-2和MDA5構成。當RIG-I和MDA5被dsRNA識別後,這兩種蛋白能夠與位於線粒體上的MAVS蛋白結合。MAVS刺激TRAF6和TRAF3。TRAF3活化TBK1刺激IRF3和IRF7誘導IFN-I的產生。目前的證據表明,Ca2+訊號通路透過調節RLR訊號中多種分子的表達,或Ca2+訊號通路與RLR訊號通路的分子相互作用調節RLR訊號通路中分子的功能。
細胞質中存在著cGAS、AIM2、DAI和DDX41等多種DNA感受器。當DAI和cGAS識別DNA後能夠啟用位於內質網上的STING,活化的STING與TBK1結合進而啟用IRF3誘發IFN的轉錄。STING也能夠啟用NF-kB誘導炎症因子的產生。目前的研究表明,透過多種分子機制,DAI、STING和TBK1能夠與Ca2+訊號通路相互作用參與抗病原微生物的免疫應答。
圖2. RLRs和DNA感受器與Ca2+訊號通路的相互作用
3、NLRs與Ca2+訊號通路
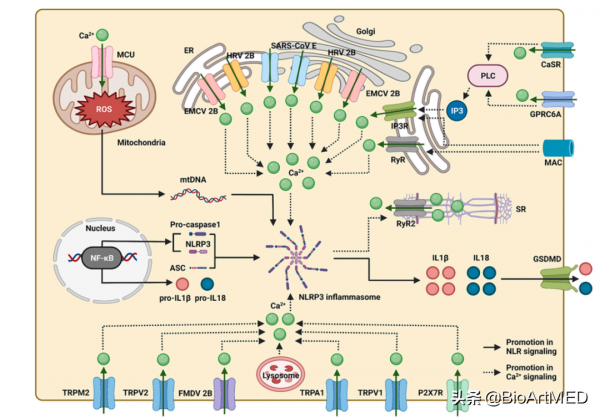
在NLR家族中,NLRP3是被研究最深入的炎症小體相關的感受器。NLPR3主要透過兩個步驟啟用。第一、透過其他的PRRs活化NF-κB,進而啟用NLRP3、pro-IL1β和pro-IL18的表達;第二、NLRP3與ASC (apoptosis-associated speck-like protein)和pro-caspase-1結合形成蛋白複合物。該複合物透過切割pro-IL1β和pro-IL18介導成熟的IL1β和IL18的產生。IL1β和IL18透過位於細胞膜上的GSDMD(pore-forming protein gasdermin D)釋放,參與炎症反應。透過位於細胞膜和不同細胞器上的Ca2+通道及病毒蛋白來源的Ca2+通道(viroporins)調節細胞質中的Ca2+水平,介導Ca2+訊號通路,調控NLRP3的啟用。NLRP3透過調節Ca2+通道RYR2調控肌漿網中的Ca2+水平。
圖3. NLPR3與Ca2+訊號通路的相互作用
4、JAK-STATs和NF-κB訊號通路與Ca2+訊號通路
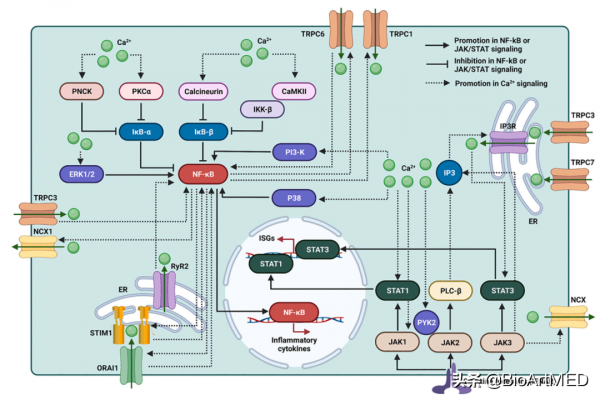
JAK-STAT訊號通路是細胞因子受體,包括IFN受體(IFNAR),主要的下游訊號通路。該訊號通路能夠誘導IFN刺激基因(IFN stimulated genes, ISG)表達參與炎症反應。目前的研究表明,JAKs,包括JAK1、JAK2和JAK3可以透過調控不同的Ca2+通道啟用該離子介導的訊號通路。相反,Ca2+訊號通路透過不同的分子機制參與JAK/STAT訊號通路的啟用介導固有免疫反應。
NF-κB是參與天然免疫的關鍵轉錄因子。在靜息狀態下,抑制性的IκB蛋白,包括IκB-α和IκB-β,可以與NF-κB p50/p65二聚體相互作用並在細胞質中形成失活複合物。透過上游IKK訊號蛋白,包括IKKα和IKKβ,IκB-α和IκB-β可被磷酸化然後以泛素-蛋白酶體方式降解,從而遊離出p65/p50二聚體。然後,p65/p50和c-Rel/p50轉運到細胞核中,調控目的基因的轉錄。目前的研究表明,Ca2+訊號通路透過不同的分子機制調控IκB-α和IκB-β,進而介導NF-κB的啟用;NF-κB透過調控不同型別的Ca2+通道的表達及活化參與Ca2+訊號通路的啟用。
圖4. JAK-STATs和NF-κB訊號通路與Ca2+訊號通路的相互作用
鄭春福教授擔任mBio編輯(中國本土編輯零的突破),Journal of Virology編委(第一批入選的2位中國本土編委之一);同時擔任Frontiers in Microbiology、Frontiers in Immunology、Virology Journal、Journal of Medical Virology副編輯以及Military Medical Research編委。
鄭春福教授在I型單純皰疹病毒(HSV-1)感染與宿主相互作用的分子機制研究、HSV-1逃逸宿主抗病毒天然免疫研究中取得突破性研究成果,在Trends in Microbiology, Microbiology and Molecular Biology Reviews (封面文章),FEMS Microbiology Reviews, Blood, Cell Host & Microbe, Proceedings of the National Academy of Sciences USA, Protein and Cell,mBio,Cytokine& Growth Factor Reviews,Journal of Virology, Journal of Immunology等主流期刊發表SCI 論文100餘篇,總引用次數2400餘次,H-index為28。
值得一提的是,鄭春福教授榮獲2019-2020年度Journal of Virology雜誌年度同行評議排行榜 (TOP25 reviewers) 以及2019-2020年度全球Publons同行評議獎(微生物學領域TOP 1%)。
實驗室網頁:
https://bms.fjmu.edu.cn/2017/1130/c2905a72170/page.htm
原文連結:
https://doi.org/10.1016/j.ijbiomac.2021.10.014
製版人:十一
轉載須知
【非原創文章】本文著作權歸文章作者所有,歡迎個人轉發分享,未經允許禁止轉載,作者擁有所有法定權利,違者必究。