最新的全球糖尿病地圖顯示,全世界共有4.63億人罹患糖尿病,相當於每11個成年人中就有1個糖尿病患者,而中國內地糖尿病人口已經達到1.16億,位居世界首位[1]。
除了已知的遺傳和環境因素,糖尿病的發生發展也與腸道菌群密切相關。腸道菌群失調可富集釋放脂多糖的革蘭陰性菌,進而增加腸道黏膜通透性,引起全身性的低度炎症,導致胰島素抵抗和糖尿病[2]。
最近浙江大學章宇教授和焦晶晶教授領導的研究團隊發現,n-3多不飽和脂肪酸EPA和DHA可透過改變腸道微生物組成和微生物代謝物來改善糖尿病小鼠的高血糖和胰島素抵抗,而且EPA的效果似乎更明顯,相關研究結果發表在Microbiome上[3]。
提到二十碳五烯酸(EPA),大家可能會比較陌生。而說到二十二碳六烯酸(DHA),我們可能腦中會自動跳出各式各樣的奶粉廣告。事實上,EPA和DHA也是大家熟知的深海魚油的主要功效成分,同屬於n-3多不飽和脂肪酸。
n-3多不飽和脂肪酸是人體必需脂肪酸以及維持細胞結構和功能的重要組成成分,以EPA和DHA為代表的n-3多不飽和脂肪酸主要來源於鮭魚、金槍魚和沙丁魚等海洋魚類[4]。近年來,有研究發現n-3多不飽和脂肪酸可恢復腸道菌群平衡及減輕炎症[5],但也有研究提出n-3多不飽和脂肪酸不能預防糖尿病[6],或是無法改善小鼠中的腸道菌群紊亂[7]。
於是,為了探究出外源性補充EPA/DHA對糖尿病狀態下腸道菌群微環境的直接和間接作用,章宇和焦晶晶課題組開展了一系列實驗。
研究人員使用的是瘦素受體基因缺陷導致的自發性2型糖尿病小鼠(db/db小鼠),本品系小鼠出生4周後就會出現肥胖、高血糖、高血脂、糖尿等一系列糖尿病的症狀,其生理性與行為性特徵與人類2型糖尿病表現極為相似,目前被認為是較理想的2型糖尿病研究用動物模型[8]。
研究結果表明,相較於對照組,飲食中加入EPA/DHA的db/db小鼠高血糖和胰島素抵抗有明顯改善。至於脂質代謝,研究人員發現外源性補充EPA的雌性db/db小鼠表現為血清甘油三酯(TG)、總膽固醇(TC)及低密度脂蛋白(LDL-C)水平明顯下降。與此同時,外源性補充EPA/DHA的db/db小鼠表現出耗氧量的增加和呼吸交換率(RER)的下降,提示其能量消耗和脂肪利用的增強。
OGTT:口服葡萄糖耐量實驗,評價血糖調節能力;ITT:胰島素耐量實驗,評估胰島素敏感性;PTT:丙酮酸耐量實驗,評估肝臟的糖異生水平
腸道菌群的多樣性對生態系統的穩定性和效率至關重要,2型糖尿病患者可表現為腸道微生物豐富度遭到破壞而導致菌群失調[2]。而EPA/DHA的補充可明顯增加db/db小鼠腸道菌群的多樣性和調節菌群物種結構組成。具體來說,DHA和EPA降低了含有脂多糖的腸桿菌科及條件致病菌,如葡萄球菌、鏈球菌和克雷伯菌的丰度。
與此同時,EPA和DHA可富集對抗內毒素血癥和炎症的雙歧桿菌(Bifidobacterium)和乳酸桿菌 (Lactobacillus)菌群,也可提高與穀氨酸水平呈負相關的紅蝽菌菌群 (Coriobacteriaceae)的丰度,增加與膽汁酸生產相關的巴恩斯氏菌屬 (Barnesiella) 和梭菌屬 (Clostridium)的丰度,以及富集某些短鏈脂肪酸(SCFAs)產生菌。值得注意的是,EPA/DHA對菌群物種結構組成的影響存在性別差異。
透過對腸道微生物組及代謝組進行KEGG分析,研究者們發現穀氨酸代謝通路是DHA/EPA主要調控的代謝通路,而動物實驗也證實EPA可降低L-穀氨酸水平及減少穀氨酸誘導的β細胞凋亡。再結合研究結果提示DHA/EPA可富集與穀氨酸水平呈負相關的紅蝽菌菌群,研究人員推測外源性補充DHA/EPA可透過提高小鼠腸道中紅蝽菌菌群丰度來加速穀氨酸降解,進而減少β細胞凋亡。
越來越多的研究證實腸道微生物與膽汁酸的相互作用在機體代謝調控中扮演重要作用。作為重要的訊號分子,膽汁酸能透過在不同器官與法尼酯衍生物X受體(FXR)的結合控制血糖、血脂和能量代謝,影響腸道激素分泌、肝糖異生和腸道菌群結構的調節[9]。
本次研究中,考慮到DHA/EPA可增加與膽汁酸生產相關的巴恩斯氏菌屬和梭菌屬的丰度,同時KEGG分析證實膽汁酸代謝通路也是DHA/EPA主要調控的代謝通路。與KEGG分析結果一致的是,透過非靶向代謝組學方法來評估不同組別糞便代謝物譜也發現膽酸(CA)和鵝去氧膽酸(CDCA)含量明顯下降。
再有,qRT-PCR結果提示DHA/EPA組糖尿病小鼠肝臟中糖異生相關基因,如磷酸烯醇丙酮酸羧激酶(PEPCK)、葡萄糖-6-磷酸脫氫酶(G6PC),mRNA表達明顯下降。而qRT-PCR和Western Blot結果也顯示外源性補充EPA或DHA可明顯增加糖尿病小鼠肝臟FXR及SHR的mRNA及蛋白質的表達水平,同時誘導FoxO1的磷酸化。
因此,課題組認為DHA/EPA可透過富集小鼠腸道中巴恩斯氏菌屬和梭菌屬的丰度來加速初級膽汁酸,CA和CDCA的生成,進而啟用FXR-SHP-FOXO1通路來抑制肝臟糖異生。
除了膽汁酸,研究人員還發現DHA和EPA干預後一些短鏈脂肪酸,例如丙酸和丁酸顯著增加。
以往研究發現,腸道菌群中的有益菌能夠分解複雜碳水化合物產生短鏈脂肪酸(SCFAs),可改善胰島素抵抗和糖代謝紊亂[10]。研究人員也發現DHA/EPA可透過增加某些短鏈脂肪酸(SCFAs)產生菌,如普雷沃氏菌屬 (Prevotella) 、擬普雷沃氏菌屬 (Alloprevotella)、梭菌屬XlVa (Clostridium XlVa) 、真桿菌屬 (Eubacterium)及腸單胞球菌屬 (Intestinimonas)的表達,進而促進腸道L細胞分泌更多的胰高血糖素樣蛋白1(GLP-1)、啟用胰島素訊號通路及白色脂肪米色化來改善db/db小鼠的糖代謝紊亂和胰島素抵抗。
為了進一步探索DHA/EPA干預後降低血糖與腸道微生物之間的因果關係,研究人員透過糞菌移植的方式,將DHA/EPA處理過的小鼠腸道微生物“傳遞”給抗生素處理過的db/db小鼠。結果顯示,接受了DHA/EPA處理後腸道微生物移植的小鼠表現出類似的腸道微生物變化,同時也恢復了葡萄糖的穩態。
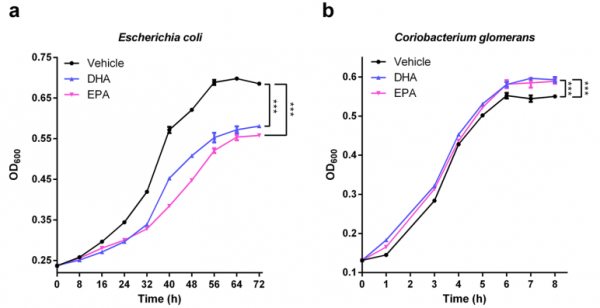
另外,儘管沒有做臨床實驗,但db/db小鼠和2型糖尿病患者均出現明顯的腸道菌群紊亂,表現為腸桿菌科丰度增加[11]和紅蝽菌屬丰度降低[12]。而體外實驗證實,EPA/DHA可以直接加快紅蝽菌屬的生長速度而降低腸桿菌科的生長速度。
因此,可推測外源性補充EPA/DHA可能透過類似的機制直接影響人類腸道微生物組。值得注意的是,儘管本次實驗發現在飲食中直接新增EPA/DHA可明顯改善糖尿病小鼠的高血糖和胰島素抵抗,但EPA/DHA能否成為治療糖尿病的“明日之星”,還需要進一步的臨床研究來證實。
1、Federation I D. IDF diabetes atlas ninth[J]. Dunia: IDF, 2019.
2、Allin Kristine H,Nielsen Trine,Pedersen Oluf,Mechanisms in endocrinology: Gut microbiota in patients with type 2 diabetes mellitus.[J] .Eur J Endocrinol, 2015, 172: R167-77.
3、Zhuang Pan,Li Haoyu,Jia Wei et al. Eicosapentaenoic and docosahexaenoic acids attenuate hyperglycemia through the microbiome-gut-organs axis in db/db mice.[J] .Microbiome, 2021, 9: 185.
4. Schulze Matthias B,Minihane Anne Marie,Saleh Rasha Noureldin M et al. Intake and metabolism of omega-3 and omega-6 polyunsaturated fatty acids: nutritional implications for cardiometabolic diseases.[J] .Lancet Diabetes Endocrinol, 2020, 8: 915-930.
5. Caesar Robert,Tremaroli Valentina,Kovatcheva-Datchary Petia et al. Crosstalk between Gut Microbiota and Dietary Lipids Aggravates WAT Inflammation through TLR Signaling.[J] .Cell Metab, 2015, 22: 658-68.
6. Brown Tracey J,Brainard Julii,Song Fujian et al. Omega-3, omega-6, and total dietary polyunsaturated fat for prevention and treatment of type 2 diabetes mellitus: systematic review and meta-analysis of randomised controlled trials.[J] .BMJ, 2019, 366: l4697.
7. Mujico Jorge R,Baccan Gyselle C,Gheorghe Alina et al. Changes in gut microbiota due to supplemented fatty acids in diet-induced obese mice.[J] .Br J Nutr, 2013, 110: 711-20.
8. Garris David R,Estrogenic stimulation of ovarian follicular maturation in diabetes (db/db) mutant mice: restoration of euglycemia prevents hyperlipidemic cytoatrophy.[J] .Cell Tissue Res, 2004, 318: 365-73.
9. Shapiro Hagit,Kolodziejczyk Aleksandra A,Halstuch Daniel et al. Bile acids in glucose metabolism in health and disease.[J] .J Exp Med, 2018, 215: 383-396.
10. Martin Alyce M,Yabut Julian M,Choo Jocelyn M et al. The gut microbiome regulates host glucose homeostasis via peripheral serotonin.[J] .Proc Natl Acad Sci U S A, 2019, 116: 19802-19804.
11. Chen Qian,Ma Xiaojing,Li Chong et al. Enteric Phageome Alterations in Patients With Type 2 Diabetes.[J] .Front Cell Infect Microbiol, 2020, 10: 575084.
12. Liu Haijun,Zhang Hong,Wang Xiao et al. The family Coriobacteriaceae is a potential contributor to the beneficial effects of Roux-en-Y gastric bypass on type 2 diabetes.[J] .Surg Obes Relat Dis, 2018, 14: 584-593.