神經退行性疾病,是一類由神經元障礙及其髓鞘喪失所致的神經性疾病,且會隨著時間的推移而不斷惡化。更重要的是,目前臨床上針對神經退行性疾病的治療方法仍十分有限。在神經退行性疾病中,亨廷頓舞蹈症等被稱為多聚谷氨醯胺(PolyQ)疾病,這類疾病是由不同基因編碼區CAG重複序列的異常擴充套件引起的。因此,抑制或沉默突變基因的表達是治療PolyQ疾病的有效方法。
其中一種方法是利用腺相關病毒(AAV)載體遞送RNAi來靶向沉默突變基因。這種方法已經在進行亨廷頓舞蹈症的早期臨床試驗(臨床試驗編號NCT04120493),在其他polyQ疾病中也接近臨床階段,如脊髓小腦共濟失調1型(SCA1)。
2021年10月18日,美國費城兒童醫院 Beverly Davidson 等人在國際頂尖醫學期刊 Nature Medicine 上發表了題為:Toxicity after AAV delivery of RNAi expression constructs into nonhuman primate brain 的研究論文。
這項研究表明,儘管在小鼠模型中使用腺相關病毒載體(AAV.miS1)遞送治療性RNAi能夠預防或逆轉脊髓小腦共濟失調1型(SCA1),且具有長期安全性。然而,在非人靈長類中的研究卻發現,AAV.miS1遞送到小腦深部核或導致小腦毒性,這與反向末端重複(ITR)驅動的轉錄毒性神經反應相關。
脊髓小腦共濟失調1型(SCA1)是一種成人發病的神經退行性疾病,由ATXN1基因編碼區CAG擴增引起。雖然ATXN1廣泛表達,但神經變性主要發生在小腦浦肯野細胞和腦幹核,患者臨床症狀包括步態和肢體共濟失調、眼球震顫、吞嚥困難和言語異常等。
在此前,研究團隊證實,透過AAV遞送miRNA,可以預防和逆轉SCA1小鼠疾病模型的行為缺陷和神經病理狀況,其安全性和益處可以持續數個月甚至一年以上。更重要的是,在非人靈長類中進行的短期試點研究也被證實是安全的。
因此,為了將這一治療技術推向患者,研究團隊在非人靈長類中啟動了實驗性新藥(IND)研究。
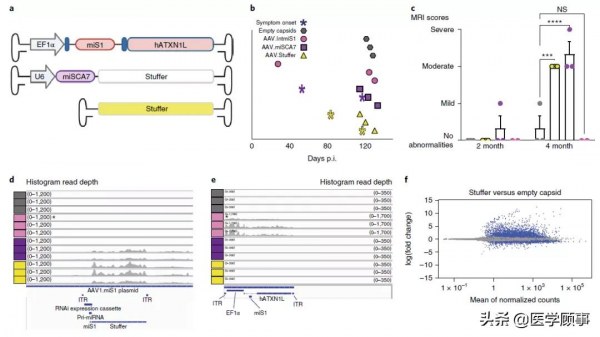
在這項研究中,為了評估AAV.miS1在非人靈長類中的長期安全性和耐受性,研究團隊以三種逐步增加的劑量給實驗動物注射,然後由外科團隊和獸醫人員完成注射後評估。大約3個月後,其中一組實驗動物出現共濟失調、震顫、頭傾斜和發音障礙。
AAV.miS1輸送至非人靈長類的小腦可導致神經功能障礙
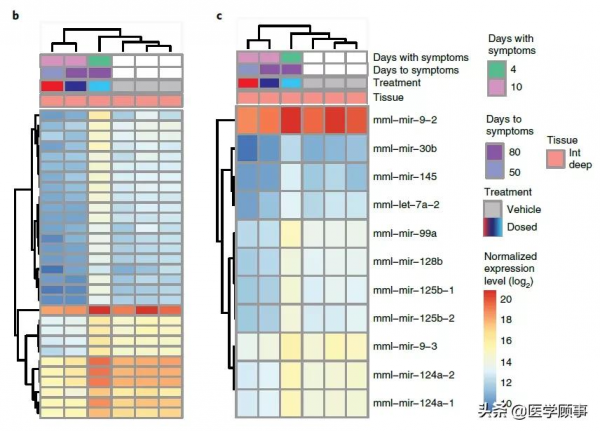
研究人員發現,各組之間的體重沒有變化,但可以注意到所有有症狀的動物都接受了AAV.miS1治療,並且在AAV-miS1遞送至小腦深部核(DCN)後,放射學評估意外地觀察到了小腦毒性。且無論是小RNA測序還是使用不含miRNA的AAV治療的研究都表明,這不是內源性miRNA加工機制飽和的結果。
AAV.miS1不會引起小RNA的失調
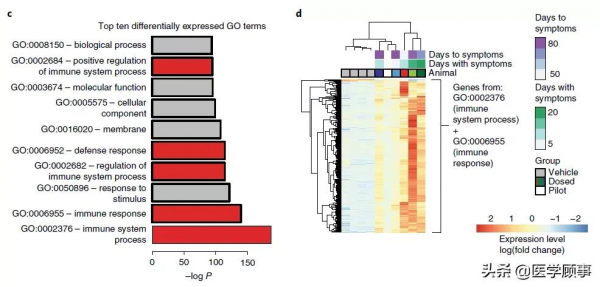
緊接著,研究小組對有症狀實驗動物的DCN組織樣本進行了RNA測序,差異表達分析顯示,AAV.miS1治療的實驗動物顯示出強烈的基因上調。基因本體論(GO)分析表明,富集程度最高的10個GO項中有5個與免疫應答相關,包括Toll樣受體、白細胞介素、趨化因子和細胞因子。
RNA-seq顯示,AAV.miS1治療的實驗動物顯示出強烈的免疫反應
那麼,為什麼AAV.miS1治療在小鼠中具有良好耐受性,但在非人靈長類中是耐受性不好呢?
RNA-seq和AAV載體的測序結果顯示,儘管交叉包裝材料的數量有限,但它們具有大量與神經病變相關的反向末端重複(ITR)啟動子活性。研究團隊進一步發現,3'端ITR的啟動子活性減弱在非人靈長類中可能具有神經毒性,但在這一現象並不會在小鼠模型中發生。
3'端ITR的啟動子活性減弱在非人靈長類中可能具有神經毒性
總而言之,這項研究表明,即使AAV.miS1治療在小鼠模型中表現出良好的治療活性和耐受性,但相同的試驗在非人靈長類中卻出人意料地表現出神經毒性。這些在齧齒類動物和非人靈長類研究結果之間的驚人對比,突顯出在評估新的人類疾病治療方法時,需要在多個物種中進行更廣泛的安全性研究!
論文連結:
https://www.nature.com/articles/s41591-021-01522-3