LioCyx-M004,是一款由來恩生物醫藥有限公司(Lion TCR)自主研發的在研HCC新藥,在其臨床前研究表明,這些經過修飾的T細胞能夠在靶標識別後裂解HBV感染的HCC細胞。與此同時,Lion TCR公司也介紹了LioCyx-M004獲得美國FDA批准的IND申請(investigational new drug)用於HCC臨床試驗。
乙肝相關HCC在研新藥LioCyx-M004,在美獲批IND申請,1b/2期研究
一、對HCC有意義創新藥進展
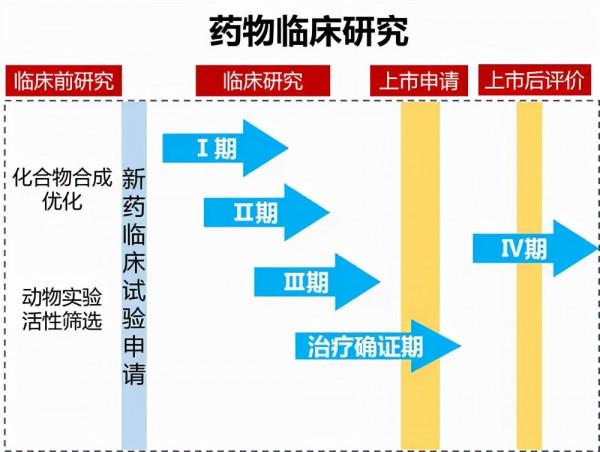
這是一項針對晚期乙肝病毒(HBV)相關HCC患者的 1b/2期多中心臨床實驗,也是全球首個將特異性T細胞受體(TCR-T)細胞療法靶向HBV相關HCC的1b/2期研究。即將進行的這項研究旨在評估LioCyx-M004作為單一療法以及LioCyx-M004+樂伐替尼組合方案使用的安全性和有效性。
考慮到樂伐替尼作為晚期HCC患者的成熟一線療法以及其促進腫瘤微環境免疫抑制恢復能力,具有作為免疫支援譜的潛力,樂伐替尼和LioCyx-M004的聯合使用有望進一步改善HBV相關HCC的臨床結果。
二、LIBERO研究將在美國進行,中國、新加坡同步申報中
Lion TCR公司營運長王婷婷博士點評如下:憑藉其獨特作用機制、出色安全性和放射學腫瘤反應,LioCyx-M004在未來有可能成為HCC患者一流的TCR-T細胞療法!我們還繼續運用強大的科學依據將TCR-T細胞療法與其他療法結合,以擴大並論證其有效性,期待在未來幾周內啟動 1b/2期研究,以改善難治性或複發性HCC患者的醫療需求現狀。
這項研究的患者招募(研究名:LIBERO),將會從美國希望之城綜合癌症中心開始,這是一家全球領先的癌症研究和治療中心,與此同時,研究也在其他國家同步申報進行中,包括中國、新加坡等。
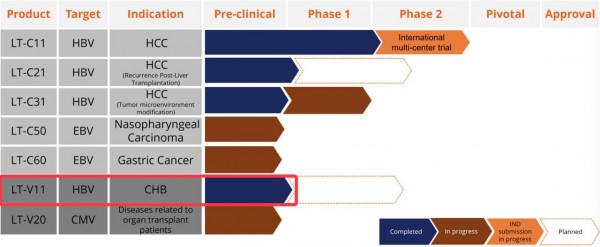
來自:Lion TCR藥物管道,紅色標註為其在研乙肝新藥專案處在臨床前階段(預計是一種免疫藥物)
Lion TCR公司CEO彭曉明博士點評如下:這項在美國獲批進行的 1b/2期臨床試驗,將為HBV-HCC患者帶來更尖端的TCR-T細胞療法提供創新選擇機會。值得一提的是,該公司另有一款在研乙肝新藥正處於臨床前研究階段。
根據來恩生物(Lion TCR)藥物管道技術開發平臺看,這是一家專注於開發免疫治療藥物公司,以對抗病毒相關的癌症。該公司開發了多種TCR-T技術平臺,同時,也是針對HCC的HBV特異性TCR重定向T細胞療法全球領先的製藥公司。
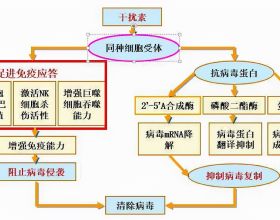
三、LioCyx-M004主要作用機理
小番健康結語:LioCyx-M004是一款該公司研發的自體T細胞在研HCC新藥,它最近獲得FDA批准在美國對HCC患者開展 1b/2期臨床研究。該候選藥物是一種TCR-T細胞創新療法,自體T細胞轉染編碼乙肝表面抗原(HBsAg)特異性TCR的mRNA,讓T細胞具有識別並靶向殺傷HBV相關HCC細胞的作用。
這是對HBV相關HCC患者的最新藥物臨床開發進展,目前,LioCyx-M004已獲批在美國開展臨床試驗(用於HCC的IND申請),並在我國和新加坡同步申報中。1b/2期研究將針對晚期的HCC患者,如需詳細瞭解該藥物和臨床試驗,可至來恩生物醫藥有限公司(Lion TCR)。