導讀:癌症疫苗是癌症免疫治療和預防的主要手段之一。癌細胞和腫瘤組織內含有各種癌症特異性和癌症相關的突變和新生抗原(Neo-antigens), 所以癌細胞和腫瘤組織本身尤其是癌細胞和腫瘤組織全細胞組分是最好的抗原庫,也是製備預防性和治療性癌症疫苗的最佳抗原原料。
2021年9月18日,蘇州大學藥學院藥劑系劉密作為通訊作者在Advanced Materials線上發表題為“Immunotherapy and Prevention of Cancer by Nanovaccines Loaded with Whole-Cell Components of Tumor Tissues or Cells” 的研究論文 (Featured),發明了一種可以通用於所有型別的癌症的預防性和治療性癌症疫苗的製備方法。該方法將癌細胞或腫瘤組織全細胞組分透過PLGA奈米粒重新組裝成奈米級的奈米疫苗,本論文也被列為藥物遞送領域的熱點話題[1]。
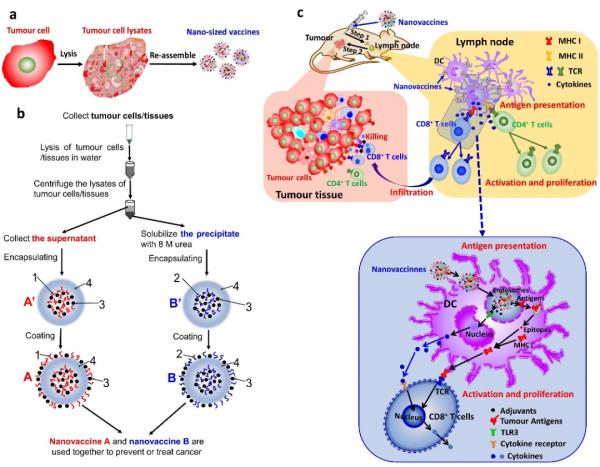
圖1(a)將癌細胞或腫瘤組織全細胞組分重組為奈米疫苗的示意圖;(b)將癌細胞或腫瘤組織全細胞組分重組為奈米疫苗的製備方案;(c)奈米疫苗引起癌細胞特異性免疫反應的作用機理圖。
最近幾年興起的癌細胞全細胞基因組分析或蛋白質組分析,可以透過與健康細胞比較分析找到某些癌細胞內的突變產生的新生抗原(Neo-antigen),採用這些抗原製備的個體化定製疫苗在臨床實驗中表現出了不錯的治療效果。但是上述疫苗費時、費力且費錢,而且一個病人只能找到有限的幾種新生抗原,並且分析的癌細胞數量有限而腫瘤組織內部癌細胞之間差異性又很大,所以其臨床應用和治療效果受到了一定的限制。
癌症疫苗所負載的癌症抗原種類越多,疫苗能刺激產生的癌細胞特異性免疫反應就會越廣泛,疫苗的效果也會越好。雖然癌細胞或腫瘤組織囊括了所有的癌症新生抗原,是最好的疫苗製備材料,但是由於傳統疫苗製備技術的侷限,我們無法制備全細胞組分的癌症疫苗。這主要是由於全細胞組分中除了水溶性組分以外還有很多非水溶性組分,而非水溶性組分無法溶於水和常用有機溶劑的特點使得其無法被負載於疫苗劑型內進行有效的藥物遞送。而細胞內這些大量的非水溶性組分(如膜蛋白等)中含有很多癌症特異性和癌症相關的突變和新生抗原(Neo-antigens),這就使得傳統的疫苗製備方法無法發揮癌症疫苗最大的功效。本研究採用8M尿素增溶癌細胞或腫瘤組織裂解產生的非水溶性組分,並將水溶性組分和非水溶性組分均負載於奈米疫苗中,這樣就成功的將癌細胞或腫瘤組織的全細胞組分重組成了奈米疫苗(圖1a和b)。
為了最大程度的增加癌症抗原的負載量,全細胞組分被同時負載於奈米疫苗內部和表面。為了增加疫苗的功效,免疫佐劑被和全細胞組分共負載於奈米疫苗中,這樣就極大地增強了奈米疫苗啟用抗原特異性T細胞的能力。抗原提呈細胞(APCs)喜歡吞噬奈米級的物質,所以奈米疫苗更容易被抗原提呈細胞吞噬並進而啟用癌細胞特異性免疫反應(圖1c)。
癌症預防性實驗結果表明(圖2),本研究所製備的奈米疫苗可以有效的預防小鼠肺癌(100%)和黑色素瘤(70%)。
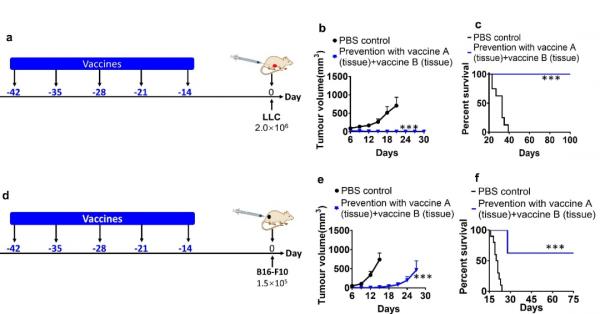
圖2奈米疫苗預防肺癌和黑色素瘤實驗結果。(a)小鼠模型中奈米疫苗預防肺癌時,疫苗給藥及腫瘤接種時刻表;(b)小鼠模型中奈米疫苗預防肺癌時,肺癌腫瘤生長曲線;(c)小鼠模型中奈米疫苗預防肺癌時,小鼠生存曲線;(d)小鼠模型中奈米疫苗預防黑色素瘤時,疫苗給藥及腫瘤接種時刻表;(e)小鼠模型中奈米疫苗預防黑色素瘤時,黑色素瘤腫瘤生長曲線;(f)小鼠模型中奈米疫苗預防黑色素瘤時,小鼠生存曲線。
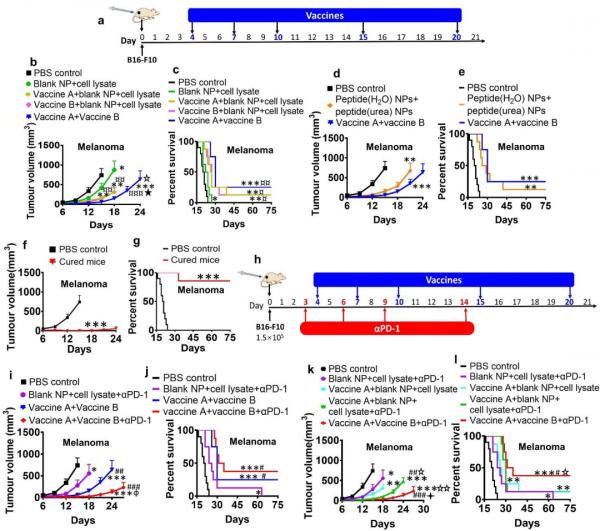
圖3奈米疫苗在小鼠模型中治療黑色素瘤的實驗結果。(a)奈米疫苗給藥時刻表;(b)和(d)腫瘤生長曲線;(c)和(e)小鼠生存曲線;(f)痊癒小鼠腫瘤二次接種後的腫瘤生長曲線和(g)生存曲線;(h)奈米疫苗與αPD-1聯合治療的給藥時刻表;(i)和(k)聯合治療時的腫瘤生長曲線;(j)和(l)聯合治療時的生存曲線。
癌症治療性實驗結果發現(圖3),奈米疫苗可以有效的治療小鼠的黑色素瘤和三陰性乳腺癌,並可使部分小鼠(25%)痊癒。而PD-1抗體可將奈米疫苗治療黑色素瘤荷瘤小鼠的痊癒率提高到40%。此外,二甲雙胍也可以進一步提高奈米疫苗的治療效果。
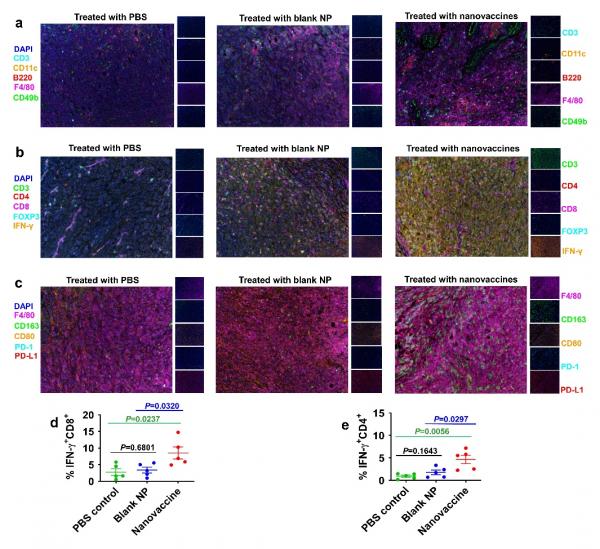
圖4. 奈米疫苗治療後小鼠的T細胞和腫瘤微環境分析。(a)對治療後腫瘤組織進行CD3(T細胞)、CD11c(樹突狀細胞)、B220(B細胞)、F4/80(巨噬細胞)、CD49b(NK細胞)和DAPI(細胞核)的多重熒光免疫組化檢測;(b)對治療後腫瘤組織進行CD3、CD4、CD8、FOXP3、IFN-γ和DAPI的多重熒光免疫組化檢測;(c) 對治療後腫瘤組織進行F4/80、CD163、CD80、PD-1、PD-L1、DAPI的多重熒光免疫組化檢測;(d)和 (e)奈米疫苗免疫治療後小鼠的脾臟中的癌細胞抗原特異性CD8+ T細胞和CD4+ T細胞含量分析。
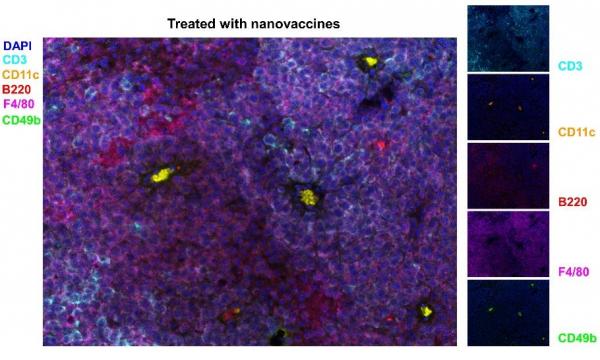
圖5. 奈米疫苗治療後的小鼠黑色素瘤腫瘤微環境中的B細胞聚集以及多種免疫細胞形成的三級淋巴結構。CD3(T細胞)、CD11c(樹突狀細胞)、B220(B細胞)、F4/80(巨噬細胞)、CD49b(NK細胞)和DAPI(細胞核)。
透過對奈米疫苗免疫化小鼠的T細胞和腫瘤微環境進行分析(圖4),研究發現奈米疫苗可以高效誘導腫瘤特異性T細胞,並同時啟用針對腫瘤細胞的適應性和先天性免疫反應。熒光多靶點免疫檢測分析顯示(圖5),奈米疫苗透過增加腫瘤微環境中免疫細胞,尤其是B 細胞,的含量等促進了腫瘤部位三級淋巴結構的形成,而最近研究表明腫瘤部位三級淋巴結構的形成對於癌症免疫治療效果至關重要。
此外,奈米疫苗增加了小鼠體內中央記憶性T細胞(Tcm)、效應記憶性T細胞(Tem)和組織駐留記憶性T細胞(Trm)的含量。這樣就使得小鼠體內產生了可以識別和殺傷癌細胞的長期免疫記憶。
本研究製備奈米疫苗的步驟簡便,可在一天或幾天內完成製備(取決於是否需要冷凍乾燥)。奈米疫苗製備所使用的PLGA和尿素均為FDA批准使用的藥用輔料,製備所得奈米疫苗劑型簡單。這些優點使得該奈米疫苗安全性較好,便於臨床轉化應用。而且由於奈米疫苗劑型簡單,這使得其便於生產和生產過程的質量控制。
總之,這項研究發現了一種通用型的癌症疫苗製備方法,可以製造基於癌細胞或腫瘤組織的奈米疫苗,該奈米疫苗可以用於癌症的免疫治療,預防癌症的發生、復發和轉移。
劉密課題組已為該奈米疫苗的製備方法、相關疫苗系統和藥物劑型系統申請了10餘項國際和國內發明專利。後續相關研究成果正在投稿中。
通訊作者簡介
劉密 蘇州大學藥學院藥劑系教授
2010年北京大學藥學院碩士畢業,2014年蘇黎世瑞士聯邦理工學院 (ETH Zürich)藥學院藥劑系博士畢業。2014年11月份開始哈佛大學醫學院免疫系博士後。2018年12月份加入蘇州大學藥學院藥劑系任特聘教授,博士生導師。主要從事預防性和治療性癌症疫苗、新冠病毒治療性中和抗體、mRNA疫苗、益生菌和免疫多靶點檢測技術等的研究。曾兩次獲得哈佛大學醫學院Mary K. Iacocca Fellowship,以通訊作者或第一作者在Nature Communications, Advanced Materials, Advanced Functional Materials, Progress in Polymer Science等國際一流雜誌發表論文多篇,已申請預防和治療性癌症疫苗、新冠病毒中和抗體、免疫多靶點檢測技術等國際專利和國內專利二十多項。
備註:
[1](Hot topic in drug delivery). https://chemistry-europe.onlinelibrary.wiley.com/doi/toc/10.1002/(ISSN)1860-7187.hottopic-drugdelivery
參考資料:
Lin Ma, Lu Diao, Zuofu Peng, Yun Jia, Huimin Xie, Baisong Li, Jianting Ma, Meng Zhang, Lifang Cheng, Dawei Ding, Xuenong Zhang, Huabing Chen, Fengfeng Mo, Honglv Jiang, Guoqiang Xu, Fenghua Meng, Zhiyuan Zhong, Mi Liu*, Immunotherapy and prevention of cancer by nanovaccines loaded with whole-cell components of tumour tissues or cells, Advanced Materials, 2021, DOI:10.1002/adma.202104849
https://doi.org/10.1002/adma.202104849
注:本文旨在介紹醫學研究進展,不能作為治療方案參考。如需獲得健康指導,請至正規醫院就診。