轉眼又到愉快週週末。在前兩篇中,小編為大家介紹了組蛋白甲基化,RBP,lncRNA三種lncRNA機制研究的新切入點,老樣子,忘得差不多的同學可以點選前兩篇文章進行復習。
讓你的lncRNA擺脫miRNA的束縛(上)
讓你的lncRNA擺脫miRNA的束縛(中)
複習中透露著疲憊.JPG
這期我們將迎來系列的完結篇,探尋lncRNA對蛋白穩定性的調控,從前面兩期的轉錄前,轉錄後水平的調控,到本期的翻譯後水平的調控。
LncRNA與蛋白穩定性(protein stability)
本節關鍵詞:蛋白穩定性,泛素化
本節文獻:Long noncoding RNA AGPG regulates PFKFB3-mediated tumor glycolytic reprogramming,nature communication
回顧前面3種lncRNA發揮功能的方式,我們可以發現lncRNA主要扮演一個間接促進者的作用,透過與功能蛋白結合,增強功能蛋白對下游靶蛋白的調控。而最後,我們來看看lncRNA是如何直接調控靶蛋白的表達。
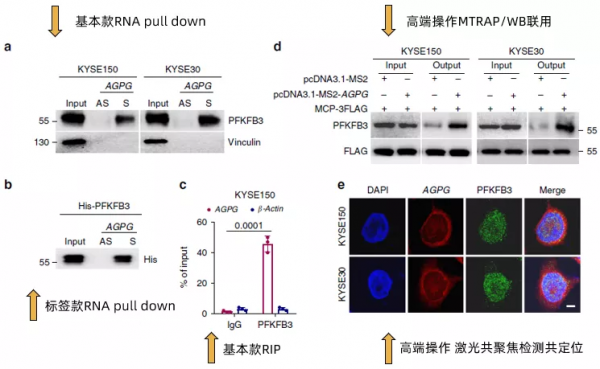
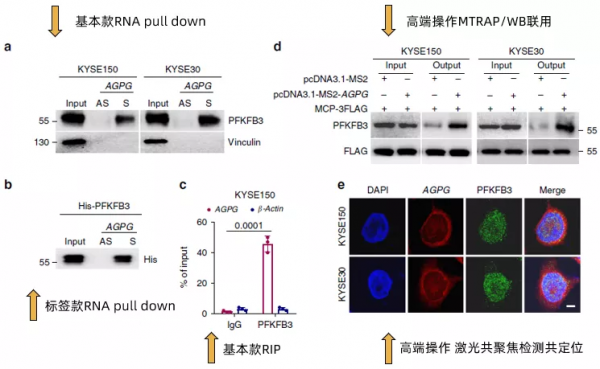
這篇範文2020發表於大家所熟知的nature communication,雖然該雜誌一直有些爭議,但是我們還是可以默默地感受一下貧富差距。作者首先說明了在之前的研究中透過RNA pull down聯用質譜的方式確認了lncRNA AGPG與靶蛋白PFKFB3的結合(沒錯,就是在lncRNA與RBP中提到的方法),然後在本文中透過RNA pull down(Fig3a,Fig3b)以及RIP(Fig3c)做了進一步的驗證。
值得注意的是,在Fig3b中作者還加入了包含His標籤的重組型外源PFKFB3的驗證。進一步地,作者使用了在之前幾篇文章中都沒有出現過的MTRAP/WB聯用(Fig3d)以及FISH/免疫熒光鐳射共聚焦共定位(Fig3e)的方法,再次驗證了AGPG與PFKFB3的結合。
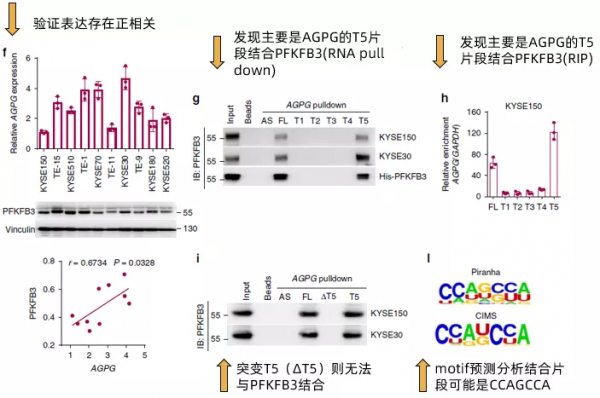
接下來,作者在多種食管鱗狀細胞癌細胞系以及臨床組織樣本中確認了AGPG與PFKFB3的表達呈現正相關(Fig3f),且其在補充材料的資料甚至做到了複製數和分子數的絕對值的對應關係(~ 400–700 AGPG molecules per cell versus ~4400–7400 PFKFB3 molecules per cell)。透過計算機分析AGPG的二級結構,發現其有5個主要的branches(還是放在了補充材料裡),透過合成全長以及這五個branches片段(T1~T5)的AGPG,作者發現T5片段是主要結合PFKFB3的區域(Fig 3g,Fig 3h)。而突變T5(ΔT5)則無法與PFKFB3結合。最後,透過motif預測分析,發現結合PFKFB3的片段可能是CCAGCCA(Fig 3I)。簡單來看,fig3的所有這些結果,其實就是說明了AGPG與PFKFB3的結合並影響了PFKFB3的表達,但是在設計上充分展示了丰度(經費)。
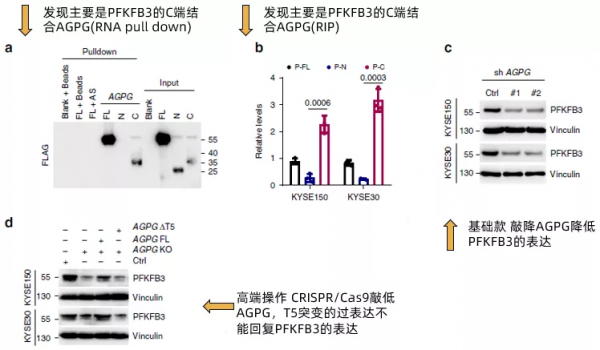
在確認了AGPG的T5片段能夠與PFKFB3結合後,作者進一步將PFKFB3拆分為全長,N端和C端,透過RNA pull down(fig4a)和RIP(fig4b)證實了PFKFB3透過C端與AGPG結合。然後,作者評估了AGPG對PFKFB3的表達的影響。AGPG沉默明顯降低PGKFB3的表達(fig4c),使用CRISPR / Cas9的CRISPR KO細胞得到了類似的結果(fig4d)。而AGPG的T5突變(ΔT5) 未能回覆PFKFB3的表達。
接下來到了關鍵的部分,作者援引文獻說明PFKFB3經常經由泛素化(polyubiquitination)修飾的方式受到蛋白酶體(proteosomal degradation)的降解。在這裡我們插播一段關於泛素化和蛋白降解的基本原理的描述:
E1泛素啟用酶(ubiquitin-activating enzyme), E2泛素偶聯酶(ubiquitin-conjugating enzymes), E3泛素連線酶(E3 ubiquitin ligase)透過給蛋白的賴氨酸殘基(K)加上泛素化標籤(ubiquitin),導致被修飾的蛋白將進入蛋白酶體中被降解。這是細胞降解蛋白的主要方式。其中,研究最廣的是E3 ligase。
回到文中,作者發現蛋白酶體抑制劑MG-132能夠恢復PFKFB3的表達(fig4e),暗示APGP沉默引起的PFKFB3的降低與蛋白酶體降解有關;且透過CHX蛋白降解實驗驗證了沉默AGPG會加速PFKFB3的降解(Fig 4f)。接下來,透過檢測蛋白的泛素化,作者發現沉默AGPG會大幅增加PFKFB3蛋白的泛素化水平(Fig 4g),增加PFKFB3與E3泛素連線酶APC/C的結合(Fig 4h),至於圖中為什麼用的是Cdc27,作者也給出瞭解釋“active APC/C could be immunoprecipitated from cells using a monoclonal Cdc27 antibody”。
最後,作者進一步確認了AGPG透過影響PFKFB3 C端的某一個賴氨酸殘基來避免其受到泛素化修飾。透過將C端四個賴氨酸(K)殘基分別突變成丙氨酸(A),作者發現只有第302位的K突變後(K302A),PFKFB3不再被AGPG沉默升高,證實AGPG影響的是PFKFB3 K302的泛素化(Fig 4i)。至此,作者完成了AGPG透過結合PFKFB3,減少PFKFB3的泛素化,從而升高PFKFB3的穩定性的論證。
由於本文對機制的研究較深,我們儘量在去除一些高階超綱操作的情況下,總結一個親民版的套路:
透過質譜或者預測,找到一個能夠與lncRNA結合的蛋白,這個蛋白最好有報道被泛素化降解。透過RIP和RNA pull down驗證其結合,透過WB,蛋白降解實驗,驗證lncRNA能夠提高蛋白的穩定性,透過檢測泛素化水平,以及co-IP實驗,驗證,lncRNA能夠透過減少靶蛋白與E3泛素化連線酶的結合,從而減少靶蛋白的泛素化。
小拓展:在本篇範文的後續結果中,作者還找到了調控AGPG的上游轉錄因子P53,有興趣的同學可以結合上一篇內容以及本文的思路假設圖自行研究 (用黃線圈出來的部分即是關於lncRNA的機制部分)
關於lncRNA與蛋白穩定性的技術總結
1. 主線是找到與lncRNA結合的蛋白,並驗證lncRNA對蛋白的穩定性有直接調控。
2. 由於選取的文獻分值區間較高,使用的技術方法比較高階,對機制的探究也比較細緻,如果要進行模仿,完全可以進行一些取捨,例如探索具體的結合片段(T1~T5, C端,N端),泛素化的賴氨酸殘基,都是非必需的。
3. 除了E3泛素連線酶,還可以找到去泛素化酶(deubiquitinase),設計成lncRNA促進靶蛋白與去泛素化酶結合。具體可參見此篇文獻,LncRNA PVT1 regulates triple-negative breast cancer through KLF5/beta-catenin signaling.
好了,到此,經過三篇推送,我們基本瞭解了lncRNA在擺脫miRNA之後的四種主要研究方向:組蛋白甲基化,RBP, 轉錄因子,蛋白穩定性。聰明的同學肯定早已發現,其本質就是探究lncRNA透過與蛋白結合,直接地或間接地影響蛋白的功能的機制。發散來看,細胞中調控蛋白功能/表達的方式遠不止這四種,那麼lncRNA能夠走的套路也是千千萬萬(是不是有點躍躍欲試呢),一些文章探索lncRNA透過相對獨特的方式調控蛋白的功能,有時也讓人眼前一亮。但是,還是要敲一下黑板,作為基層科研工作者,切忌好高騖遠,既不要覺得lncRNA繼續綁著miRNA來做就很低端,也不要盲目地覺得直接上lncRNA與蛋白就一定能發高分。最後我們對本系列的內容再做個技術總結吧,預祝大家手頭的lncRNA都能發光餘熱。
系列總結
1. 創新型除了與探究的lncRNA的機制有關,也與研究的下游表型,以及lncRNA本身有關。並不是說哪種機制就更新穎。
2. RIP,RNA pull down,CHIP,Co-IP這些技術是研究lncRNA與蛋白關係的關鍵技術,如果想要往這方面嘗試的同學務必掌握牢固。
3. 綜合兩種以上的機制,甚至是將ceRNA也融合進來,是常用的增加文章的層次的方法。